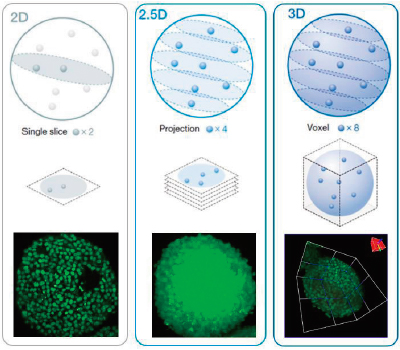
Flujo de trabajo analítico para ensayos de células vivas/muertas 3D
Resumen
El software de análisis celular 3D NoviSight proporciona datos estadísticos sobre esferoides y otros objetos en 3D al medir parámetros como el volumen, la esfericidad y el número de células. Esta nota de aplicación explica el flujo de trabajo analítico celular 3D NoviSight para un ensayo con esferoides vivos/muertos.
Introducción
El análisis de alto contenido 3D (HCA) al usar esferoides u orgánulos puede resultar complejo. Idealmente, se pueden analizar muestras 3D para obtener información sobre su morfología y su condición interior. El análisis 3D real del software NoviSight puede simplificar este proceso midiendo el volumen, el número de células y la condición celular de las muestras 3D basándose en las imágenes fluorescentes de pila Z secuenciales. Por otro lado, el análisis convencional utiliza un único segmento de imagen (Figura 1, izquierda, análisis en 2D) o utiliza una imagen de proyección (Figura 1, centro, análisis en 2,5 D). Las dos técnicas pierden muchos datos de la muestra 3D, como la información espacial, morfológica y volumétrica (Figura 1). En esta nota de aplicación, se demostrará cómo analizar las muestras 3D de forma cuantitativa con el software NoviSight y un ensayo de esferoides vivos/muertos. |
Figura 1 (de izquierda a derecha): esquema de análisis en 2D, 2,5D y 3D. |
Métodos
Preparación de la muestra
Se cultivaron 500 células HT-29/pocillo en una placa PrimeSurface® 96U (Sumitomo Bakelite) durante ocho días para formar esferoides y después aplicamos varias concentraciones de estaurosporina (STS) con NucView® 550 (Biotium) al día siguiente. NucView 550 es una sonda fluorescente CASP; el núcleo de la célula muerta fue teñido de rojo en fluorescencia. Después del tratamiento con el STS y NucView 550, los esferoides HT-29 fueron fijados con paraformaldehído al 4 % y se permeabilizaron con Triton X-100/PBS(-) al 0,5 %. El núcleo de los esferoides se tiñó con Hoechst 33342 a 4 °C (39,2 °F) durante la noche. Después de la tinción, los esferoides se aclararon con SCALEVIEW-S4.
Procesamiento y análisis de imágenes
Se visualizaron las muestras en tres dimensiones usando el microscopio confocal FV3000 y una lente de objetivo semiapocromático (LUCPLFLN20X). A continuación, es posible visualizar las condiciones de adquisición. El tamaño del paso Z era de 2 μm. Se utilizó un láser de 405 nm para Hoechst 33342 (fluorescencia azul) y un láser de 561 nm para NucView 550 (fluorescencia magenta). La Figura 2 muestra imágenes volumétricas de esferoides tratados con
el STS y sin tratar, adquiridas con el microscopio. El núcleo de un esferoide cultivado durante 8 días y sin tratamiento parecía muerto posiblemente por la baja nutrición o hipoxia. En general, podemos afirmar que el STS indujo la muerte celular de los esferoides de HT-29.
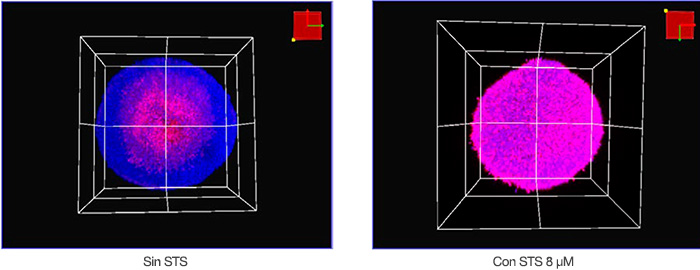
Figura 2: Vista volumétrica de esferoides de HT-29 con STS (derecha) y sin STS (izquierda).
Beneficios
- Se realiza con facilidad ensayos de viabilidad de células vivas/muertas en 3D
- Interfaz de usuario intuitiva que ayuda a transformar las imágenes de apilamiento en Z en datos cuantitativos reproducibles
Estrategia de análisis de células vivas/muertas 3D
Los pasos descritos en la Tabla 1 son necesarios para analizar cuantitativamente los esferoides vivos/muertos usando el software NoviSight™. Para que el software NoviSight pueda reconocer el núcleo de las imágenes de plano Z en tres dimensiones, es necesario definir el tamaño de paso de la sección Z en 3 μm (la medición más grande para detectar un único núcleo).
| Paso | Detalles |
| Preparación de la muestra |
Cultivo celular y tinción fluorescente
Opcional: fijación y lavado Si se analiza el número de células se debe teñir el núcleo ↓ |
| Procesamiento de imágenes |
Adquisición de varias imágenes de apilamiento en Z,
(p. ej., microscopía confocal, microscopía multifotón) ↓ |
| Análisis |
1. Reconocer los objetos de interés, como núcleo, volumen, orgánulo
2. Definir los parámetros de análisis 3. Análisis gráfico con pasarelas 4. Análisis estadístico |
Tabla 1: Flujo de trabajo analítico 3D — de la preparación al análisis de la muestra
Pasos de análisis del software NoviSight
Reconocimiento del objeto principal
El ensayo de células vivas/muertas fue evaluado por el número de células vivas/muertas. El software NoviSight puede detectar el número de células a partir de las tinciones nucleares. Para reconocer el núcleo de la célula, usamos un módulo NoviSight especializado para la detección nuclear: NuclearL. Si se introduce el tamaño de célula adecuado, la intensidad de fondo y la relación Z/XY (elongación del eje Z para el núcleo), el software NoviSight puede detectar automáticamente el núcleo del esferoide en el espacio 3D (Figura 3A).
Configuración de parámetros analíticos
En el caso de todos los núcleos teñidos con Hoechst 33342, los que tienen una intensidad de señal NucView 550 alta eran las células muertas. Como resultado, el software NoviSight puede clasificar las células vivas/muertas por los niveles de intensidad (NucView 550) CH2 en los objetos de núcleos reconocidos (Figura 3B). Esto significa que el software NoviSight puede clasificar las células vivas/muertas de los esferoides usando el ajuste de reconocimiento del núcleo.
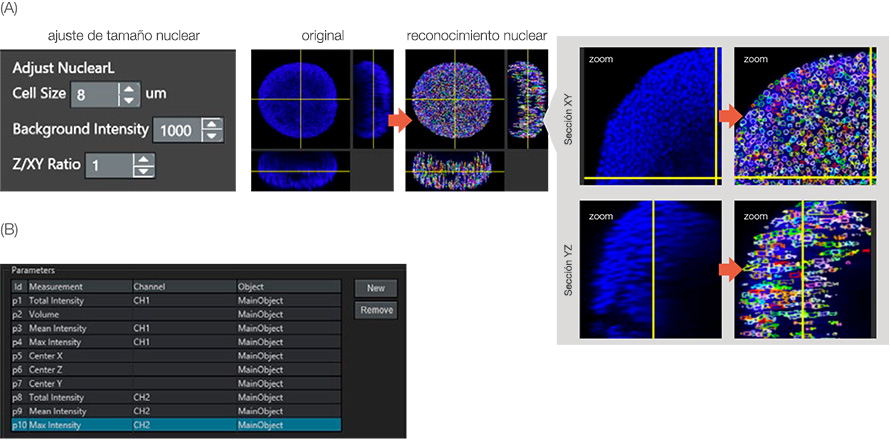
Figura 3: Reconocimiento de objetos parentales. (A) Núcleo reconocido por el módulo NuclearL. Cada núcleo reconocido está rodeado por un círculo de color. (B) Parámetros de análisis definidos. Por ejemplo, el parámetro 10 es la intensidad máxima de CH2 (señal muerta) en el objeto principal (núcleo).
Una vez finalizado el reconocimiento del núcleo, el núcleo reconocido puede representarse como datos de objeto en un histograma o un diagrama de dispersión. El eje X o el eje Y del diagrama de dispersión puede ajustarse a partir de los parámetros analíticos. Si se ajustan en el centro X/Y respectivamente, el centro X/Y de los objetos principales se representan en el gráfico (Figura 4A). Al hacer clic en un punto del gráfico, el software NoviSight puede
apuntar a la misma dirección en la imagen original (Figura 4B).
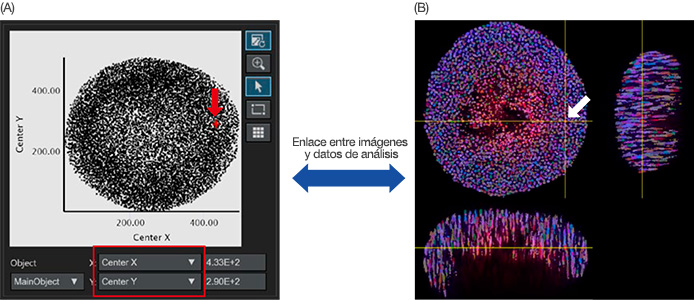
Figura 4: Imagen de un análisis cuantitativo de un esferoide. (A) Cuando los parámetros del análisis X e Y del centro (definidos en la Figura 3B) se han definido en los ejes X e Y respectivamente, cada núcleo reconocido se ilustra en el gráfico. Los parámetros analíticos en el eje X/Y pueden ajustarse cuando es necesario (cuadrado rojo). (A/B) El software NoviSight puede relacionar visualmente los datos analíticos con las imágenes originales. Al
hacer clic en el diagrama nuclear reconocido en el gráfico A (A, flecha roja), la misma posición se muestra automáticamente en la imagen original (flecha blanca).
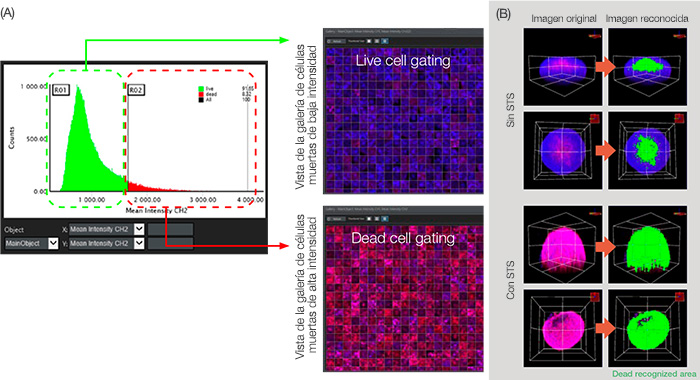
Figura 5: Análisis gráfico para la clasificación celular.
(A) Cuando la intensidad media del parámetro de análisis CH2 (definido en la Figura 3B) se ha definido en el eje X e Y respectivamente, el gráfico muestra el recuento del objeto principal (núcleo) en el orden de la intensidad media CH2 (señal muerta). A través de la pasarela de intensidad CH2, se pudo dividir las células vivas y las células muertas. (B) Vista volumétrica del área muerta reconocida de color verde.
Análisis estadístico
El software NoviSight puede analizar varias muestras simultáneamente. Los datos cuantitativos del análisis pueden ser visualizados como un mapa térmico (Figura 6A) o pueden exportarse como un archivo CSV para análisis posteriores. Los datos también pueden generarse para cada pasarela. Aquí, los datos indican que el STS indujo una apoptosis celular de HT-29 de forma supeditada a la dosis, cuando las diversas concentraciones de STS se trataron con esferoides HT-29 (Figura 6B).
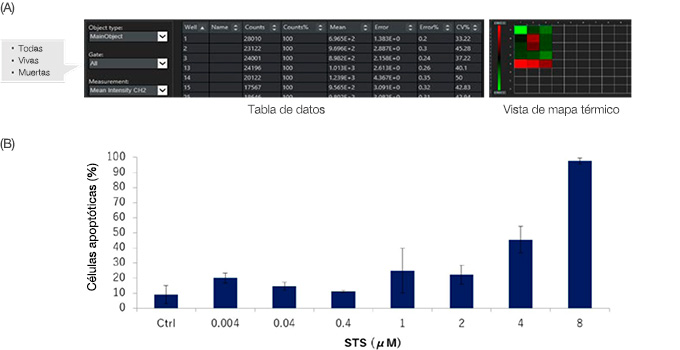
Figura 6: Resultados de cuantificación de análisis de células vivas/muertas para esferoides de HT-29 con y sin STS. (A) El software NoviSight genera datos de cuantificación para cada pasarela.
Los datos también pueden visualizarse en un mapa térmico. (B) El STS aumentó la muerte de células HT-29 de forma supeditada a la dosis.
Conexión de datos e imágenes
La asociación entre datos e imágenes es una ventaja clave para el análisis de alto contenido. A diferencia del lector de placas, la HCA puede hacer referencia a la imagen original para confirmar visualmente la morfología, la posición o la intensidad de las células. El software NoviSight™ aprovecha todas las ventajas de esta característica. Por ejemplo, el software puede mostrar la imagen correspondiente al hacer clic en un punto de datos o en un objeto específico (Figura 7), como:
- Un punto en un diagrama de dispersión
- Una imagen de objeto en una vista de galería
- Un pocillo en un mapa térmico
- Un número en una tabla
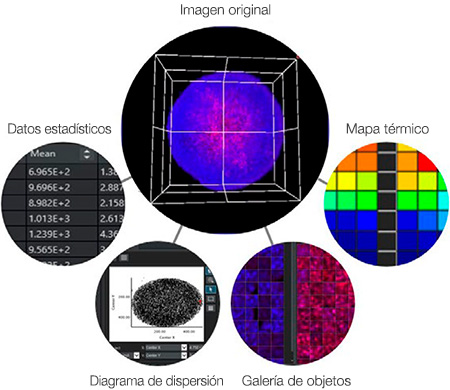
Figura 7: Software NoviSight mostrando el mismo punto en la imagen correspondiente al hacer clic en un objeto o en un punto de datos.
Conclusión
Un análisis cuantitativo 3D de muestras 3D puede parecer complicado, pero el software NoviSight puede agilizar su proceso de trabajo de principio a fin. Por ejemplo, el reconocimiento nuclear es el único parámetro que necesitamos para análisis de células vivas/muertas en los esferoides. Este flujo de trabajo racionalizado también puede aplicarse a los modelos 3D relevantes.
Autor
Mayu Ogawa (Olympus)
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.