2.da parte — Comparación de líneas celulares humanas iPS con el sistema de monitorización de incubación CM20: Variaciones en la eficiencia de la diferenciación de organoides hepáticos derivados de células iPS
Introducción
Las células madre pluripotentes inducidas (iPS) son usadas con bastante frecuencia en investigaciones básicas de biología del desarrollo, como la diferenciación celular y la formación de órganos, pasando por la investigación traslacional asociada al descubrimiento de fármacos y desarrollo de métodos de diagnóstico para enfermedades. La tecnología de construcción de minitejidos u órganos derivados de células humanas iPS, denominados organoides u orgánulos (entre otras terminologías), ha progresado rápidamente hasta el punto de que los tejidos tridimensionales pueden ser usados como avatar de los órganos humanos. Hasta la fecha, muchas líneas celulares de iPS evidenciadas a nivel mundial —tanto a partir de individuos sanos como enfermos— pueden usarse para estudios de organoides, cuyo objetivo es esclarecer los antecedentes genómicos de las enfermedades y la predisposición de cada paciente a padecer enfermedades mediante la evaluación de las diferencias funcionales e individuales de los organoides generados. Sin embargo, el proceso de generación de organoides para órganos diana generalmente abarca más de un mes y es costoso. La estabilidad y reproducibilidad de la generación de organoides sigue siendo un desafío importante debido a la variabilidad que existe en la capacidad de diferenciación y la tasa de proliferación entre las líneas celulares de iPS consideradas. Esta es una de las barreras para el desarrollo investigativo de organoides basada en la comparación de múltiples muestras derivadas de diferentes células iPS.
Para aportar una solución a este problema, los investigadores de este experimento monitorearon células iPS de forma cuantitativa durante un largo período de tiempo. Esto a fin de diseccionar mejor las diferencias a partir del estado indiferenciado y su relación con la variación dependiente de cada línea celular en la diferenciación de organoides.
Entre las líneas de células humanas iPS derivadas de 12 donantes, ciertas líneas no lograron diferenciarse a menudo en organoides hepáticos, a pesar de recibir el mismo protocolo de diferenciación usado en todas las líneas celulares analizadas. En esta nota de aplicación, se recoge un experimento con el objetivo de comprender mejor la relación de las líneas celulares iPS entre las propiedades en estados indiferenciados, antes de la inducción de la diferenciación, y el potencial de diferenciación en organoides hepáticos.
Uso de los datos de monitorización de las células iPS provenientes del sistema CM20 para evaluar la diferenciación de organoides
El sistema de monitorización de incubación CM20 de Olympus permitió medir el estado del cultivo de forma cuantitativa y adquirir datos de medición que podrían ser comparados fácilmente con resultados anteriores. Los datos relativos a la cantidad de colonias de células iPS y densidad pudieron ser exportados fácilmente a un archivo CSV para un análisis más detallado.
En este estudio, se monitoreó el crecimiento de líneas celulares humanas iPS derivadas de 12 donantes durante el período de mantenimiento; después, se exportó la cantidad de colonias basadas en el tiempo y los datos de densidad conforme a cada línea celular. A continuación, se explica el protocolo de diferenciación que han desarrollado recientemente (*1) los investigadores de este experimento para obtener organoides hepáticos. Alrededor de un mes después, se hizo el recuento de la cantidad de organoides generados y se midió el nivel de secreción de albúmina en función del organoide hepático. También, se compararon los datos de crecimiento de las células iPS obtenidos antes de la diferenciación con los datos de sus organoides hepáticos correspondientes por cada línea celular.
Protocolo de cultivo y análisis de datos
Se mantuvieron doce líneas de células humanas iPS en una placa de 6 pocillos bajo condiciones exentas de alimentador. Alrededor de una semana después del paso, las células fueron disociadas en células individuales con Accutase y, luego, se cultivaron en una nueva placa. Los cultivos fueron estimulados con Activina A y BMP4 para diferenciar los estados indiferenciados de endodermos definitivos. Después, fueron tratados con FGF4 y agonista Wnt para obtener esferoides del intestino anterior y posterior. Para hacer el cambio a un cultivo tridimensional, se integraron estos esferoides en una mezcla Matrigel —matriz de la membrana basal—, seguida de una acción de ácido retinoico (RA) durante la etapa inicial de formación de los organoides. Adicionalmente, las células fueron cultivas en un medio de diferenciación hepática por alrededor de un mes, lo que llevó a la generación de organoides hepáticos (Figura 1A).
Tras ello, se contó el número de organoides y midieron los niveles de secreción de albúmina a través de un ELISA a partir las muestras recogidas del medio. Se integraron los datos de proliferación celular indiferenciados iPS, que se obtuvieron con el sistema de monitorización CM20, y se analizó la correlación entre las características durante el cultivo de mantenimiento y la eficiencia de la diferenciación organoide de cada línea celular iPS (Figura 1B).
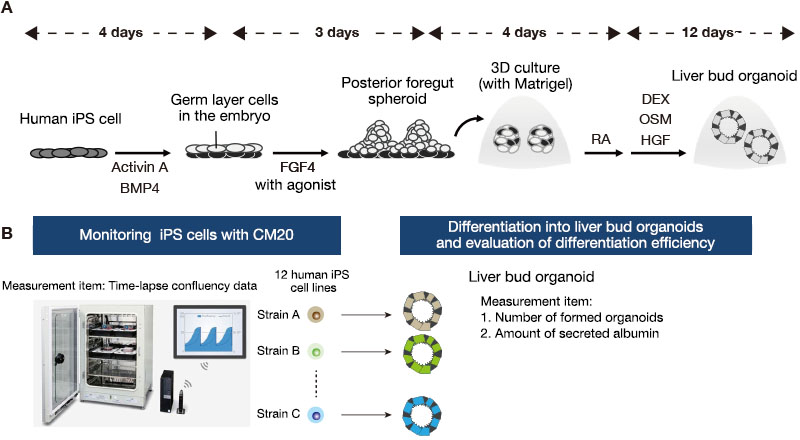
Figura 1. Monitoreo de células humanas iPS durante el cultivo de mantenimiento, y evaluación de la eficiencia de la diferenciación de organoides hepáticos.
(A) Protocolo de cultivo utilizado para la diferenciación de células humanas iPS en organoides hepáticos.
(B) Resumen del análisis comparativo entre las características de las células iPS durante el período de mantenimiento y la eficiencia de la diferenciación de organoides hepáticos a través de las 12 líneas de células iPS derivadas de diferentes donantes.
En todo el proceso de inducción de las 12 líneas de células humanas iPS para la diferenciación en organoides hepáticos, se pudieron obtener organoides a partir de la mayoría de las líneas celulares. Sin embargo, a menudo no se alcanzaba la diferenciación de las líneas de células iPS I y J (Figura 2A). Aunque la secreción de albúmina (cantidad de secreción por organoide) varió según el lote de inducción diferencial, los organoides hepáticos derivados de las líneas celulares iPS I y J, que tienen una eficiencia de formación de organoides extremadamente baja, mostraron a su vez niveles bajos de secreción de albúmina (Figura 2B). Entre las líneas celulares con alta eficiencia de formación de organoides, se notó también que algunas líneas celulares iPS, como la línea C, muestran una secreción de albúmina relativamente baja. Para validar aún más la diferenciación, se confirmó que los organoides hepáticos derivados de líneas de células iPS, distintas a la I y J, expresaban marcadores específicos de hepatocitos (datos no mostrados). Estos datos evocan que entre las 12 líneas celulares analizadas, las líneas celulares iPS I y J tienen una capacidad limitada para ser diferenciadas en el linaje hepático.
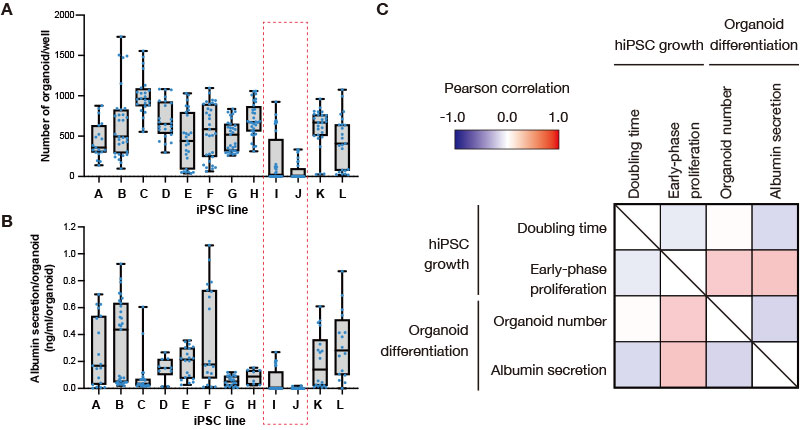
Figura 2. Análisis de correlación entre la proliferación de células iPS, antes de la inducción de diferenciación, y la eficiencia de la diferenciación en los organoides hepáticos a través de líneas celulares humanas iPS.
(A, B) Cantidad de organoides hepáticos formados durante los experimentos de inducción de diferenciación múltiple (A) y el nivel de secreción de albúmina (B), representados en un diagrama de caja conforme a cada línea celular iPS. Los puntos azules corresponden a la cantidad de pocillos medidos durante múltiples experimentos llevados a cabo de forma independiente.
(C) Mapa de correlación que muestra los parámetros de crecimiento de las células humanas iPS, durante el período de mantenimiento (tiempo de duplicación y proliferación de fase temprana), y la diferenciación de organoides hepáticos (número de organoides y secreción de albúmina).
Para investigar si el estado de las células iPS antes del paso de inducción a la diferenciación afecta la eficiencia de la diferenciación de organoides hepáticos, se analizó posteriormente la correlación de los parámetros de proliferación adquiridos por el sistema CM20, la cantidad de organoides formados y la secreción de albúmina correspondiente a cada experimento de inducción a la diferenciación. Se calcularon los coeficientes de correlación entre el tiempo de duplicación de las células iPS, antes de la inducción a la diferenciación (cálculo ejecutado con los datos de confluencia provistos por el sistema CM20), la eficiencia del crecimiento en la etapa inicial de proliferación (cálculo resultante a partir de una fórmula definida por el Dr. Takebe), la cantidad de organoides hepáticos generados y los niveles de secreción de albúmina por cada experimento. Se consideraron las variaciones basadas en lotes mediante el análisis del conjunto de datos de cada experimento (Figura 2C). Si bien la cantidad de organoides hepáticos generados y los niveles de secreción de albúmina no mostraron casi ninguna correlación con el tiempo de duplicación de las células iPS, se correlacionaron positivamente con los parámetros relativos a la eficacia de la proliferación en la etapa inicial de la proliferación de las células iPS. Esto indica que, aunque las diferencias simples a nivel del tiempo de duplicación entre las líneas celulares iPS no pueden ser usadas para determinar si los organoides hepáticos generados son buenos o malos en sus cualidades, es posible que algunas diferencias en las primeras etapas de la proliferación celular iPS —observadas entre líneas celulares— afecten la eficacia de la posterior diferenciación organoide hepática.
Conclusión
Los datos cuantitativos del sistema CM20 permitieron que los investigadores del estudio obtengan información de cultivos celulares anteriores hasta, e incluso, después de la diferenciación en organoides. Las imágenes y los datos son fáciles de exportar, lo que permite una variedad de análisis que pueden conducir a nuevos conocimientos durante el proceso de cultivo.
En este estudio, se descubrió que la eficiencia variable de la diferenciación de organoides hepáticos a través de líneas celulares iPS puede verse significativamente afectada por la eficiencia del crecimiento de las células iPS durante el período de mantenimiento, en especial, en la etapa temprana de crecimiento. Esto indica que para generar organoides hepáticos más estables y de mayor calidad, es importante monitorear el estado de las células iPS inmediatamente después del paso con la intención de saber si están listas para la inducción de la diferenciación. Basándose en esta correlación, también es posible prever cuándo una línea celular tendrá una eficacia de diferenciación buena o deficiente mediante la monitorización del estado proliferativo de las líneas celulares iPS.
Olympus emprenderá nuevas investigaciones con el sistema CM20 para desarrollar métodos que permitan un control de calidad y una gestión de datos eficientes.
Comentarios del Dr. Takebe y el Dr. Yoneyama
Dr. Takanori Takebe (izquierda)
| Al tratar múltiples líneas celulares iPS derivadas de diferentes donantes y evaluar las diferencias entre los donantes que presentan organoides derivados de células iPS, con frecuencia, nos encontramos con el problema de que la eficiencia de la diferenciación varía entre las líneas celulares iPS. Las ventajas del sistema CM20, incluida la monitorización estable de los estados de proliferación y la capacidad de exportar los datos, nos resultaron muy útiles para analizar la correlación entre la proliferación de líneas celulares iPS y la eficiencia de la diferenciación de los organoides, generados a partir de 12 líneas celulares analizadas de forma simultánea. |
Referencias bibliográficas:
*1) Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, Thompson W, Karns RA, Mayhew CN, McGrath PS, McCauley HA, Zhang RR, Lewis K, Hakozaki S, Ferguson A, Saiki N, Yoneyama Y, Takeuchi I, Mabuchi Y, Akazawa C, Yoshikawa HY, Wells JM, Takebe T. Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids. Cell Metabolism, 30 (2): 374–384 (2019)
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
