Automatización del proceso de selección de medicamentos: desde la preparación de esferoides tumorales hasta el análisis de imágenes 3D
Resumen
Hoy, es posible automatizar casi por completo el flujo de selección de medicamentos para esferoides cancerígenos mediante una solución que combina el sistema de selección y procesamiento de imágenes automatizado de células CELL HANDLER™ de Yamaha, nuestro microscopio de escaneo láser confocal FLUOVIEW™ FV3000 y nuestro software NoviSight™. Esta solución comprende operaciones que van desde la etapa de preparación hasta el análisis de imágenes 3D. Un flujo de trabajo automatizado hace posible la ejecución de ensayos con un alto número de modelos celulares 3D de una manera estable y eficiente.
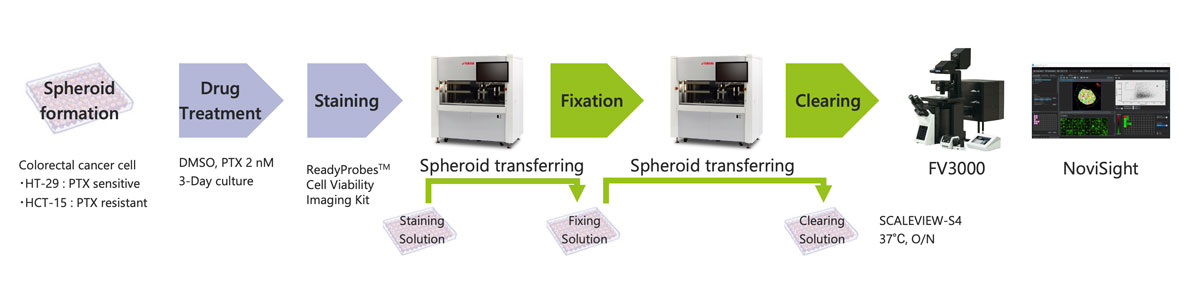
Figura 1. Flujo de selección de medicamentos para los esferoides cancerígenos
Introducción
Evaluar el rendimiento de un medicamento en esferoides cancerígenos tridimensionales es importante porque éstos reflejan el complejo microentorno in vivo del cáncer de una forma más adecuada que los modelos bidimensionales. Esto permite a los investigadores evaluar la eficacia del medicamento bajo condiciones que se asemejan más al microentorno natural del tumor.
Sin embargo, hay que dedicar bastante tiempo a la preparación, la tinción, el procesamiento de imágenes y el análisis 3D de estas múltiples muestras. Para simplificar este flujo de trabajo, hemos automatizado la preparación, fijación y tinción de esferoides con el sistema CELL HANDLER™ de Yamaha, así como la adquisición de imágenes y análisis 3D con el sistema FV3000 y el software NoviSight™.
Ventajas
- El sistema CELL HANDLER permite la preparación de muestras sin dañar las células y sin desperdiciar la muestra. Además, las capturas de los esferoides se ejecutan antes y después de la transferencia de muestras; gracias a ellas, varios parámetros pueden ser analizados para garantizar una trazabilidad completa.
- El microscopio de escaneo láser confocal FV3000 y el software NoviSight puede ejecutar análisis tridimensionales de múltiples muestras fácilmente. Es posible cuantificar las diferencias a partir de los efectos de los medicamentos dentro y fuera del esferoide.
Métodos
Preparación de la muestra de esferoide tumorales
En primer lugar, usando una placa con fondo en U de fijación ultrabaja, se crearon esferoides con un diámetro de 100 µm que fueron tratados con 2 nM de Paclitaxel (PTX) o DMSO. Tras un período de cultivo de tres días, los esferoides fueron teñidos con el kit de procesamiento de imágenes de viabilidad celular ReadyProbe™ (verde/azul) y transferidos a una placa con solución fijadora para su tratamiento de una noche a 4 °C. Después, las células fueron transferidas al reactivo de clarificación SCALEVIEW-S4 y tratadas toda la noche a 37 °C. Todas las transferencias de muestras fueron ejecutadas con un CELL HANDLER de Yamaha.
Procesamiento de esferoides en imágenes y su análisis a partir de placas de pocillo
Con el fin de adquirir múltiples imágenes fluorescentes a partir de los esferoides ubicados en la placas, se usó el microscopio de escaneo láser confocal FV3000. Los datos obtenidos a partir del procesamiento de imágenes fueron importados al software de análisis celular 3D NoviSight; éste reconoció células vivas y muertas en las imágenes 3D y calculó con precisión las tasas de viabilidad de cada pocillo.
Resultados
Procesamiento y análisis de imágenes con el sistema CELL HANDLER™ de Yamaha
El sistema CELL HANDLER™ puede adquirir imágenes y datos morfológicos antes y después de la transferencia de muestra. Las imágenes muestran que la mayor parte de los esferoides fueron transferidos con éxito, es decir que no hubo pérdida de muestras (Figura 2).
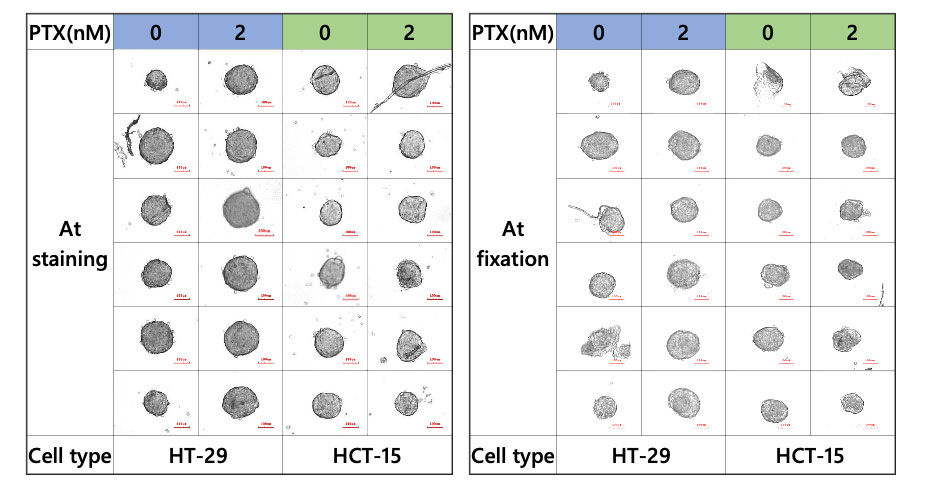
Figura 2. Esferoides durante la etapa de tinción y fijación
No se observaron diferencias de área entre los esferoides tratados con o sin el paclitaxel (PTX). Sin embargo, las señales fluorescentes mostraron que el PTX redujo significativamente la cantidad de células vivas en la línea HT-29, mientras que no se produjo ninguna reducción en la HCT-15 (Figura 3).
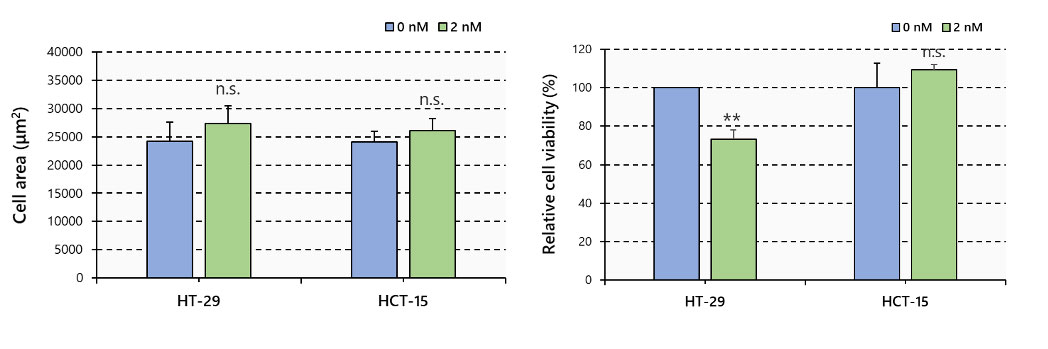
Figura 3. Área de esferoides y viabilidad celular, N=6, **: p < 0.01; barras de error: SE
Adquisición y análisis de imágenes 3D con el sistema FV3000 CLSM y el software NoviSight
Para analizar el efecto del PTX en el microambiente de los esferoides, los esferoides fueron observados con el microscopio FV3000 (Figura 4).
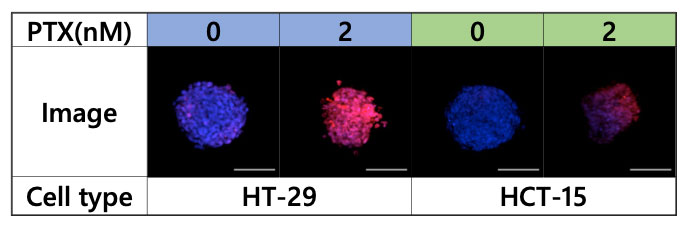
Figura 4. Imágenes adquiridas con el microscopio FV3000, azul: núcleos (todas las células), rojo: núcleos (células muertas)
Tras la observación, múltiples imágenes 3D fueron cargadas en el software NoviSight para ejecutar el análisis 3D; a través de este, se demostró que el PTX redujo en gran medida la cantidad de células viables en la línea HT-29 y afectó en gran medida al esferoide desde el centro hacia el interior. Por otra parte, se observaron menos efectos en la línea celular HCT-15 (Figura 5).
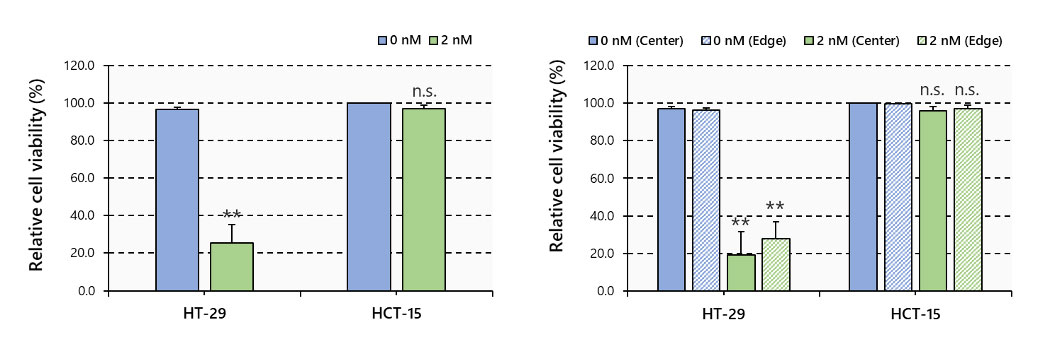
Figura 5. Viabilidad celular mediante el análisis de imágenes 3D, N=3~6, **: p < 0.01; barras de error: SE
Conclusión
El sistema CELL HANDLER de Yamaha simplifica la preparación de grandes cantidades de muestras de esferoides. Las muestras pueden ser analizadas fácilmente en tres dimensiones con un microscopio FV3000 y el software NoviSight. La precisión del análisis celular 3D puede ser optimizado gracias a la alta trazabilidad que ofrece este flujo de trabajo automatizado.
Autor
Hiroya Ishihara, Ingeniería Biológica, Investigación y Desarrollo, Evident
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.