Automatización del procesamiento de imágenes y la cuantificación en los ensayos de migración mediante un sistema de monitorización de incubación
Esquema experimental
La información asociada a la migración celular resulta valiosa en muchas áreas de investigación, como en la cicatrización y el cáncer. En el ámbito de la cicatrización, esta información sirve para evaluar fármacos que promuevan la migración celular con el fin de reparar heridas. En el ámbito del cáncer, es usada para evaluar medicamentos que suprimen la metástasis y la infiltración de células cancerosas. Una forma de medir esto es a través de un ensayo de migración, en el que se observa la migración de células adherentes, colocadas en una placa de cultivo tisular, hacia un espacio exento de células. La parte más importante y desafiante al efectuar un ensayo de migración es determinar la duración adecuada de la migración. Un ensayo de migración analizado demasiado pronto no muestra diferencias entre las condiciones; asimismo, uno analizado demasiado tarde da como resultado áreas abiertas que se han llenado por completo con células tanto a partir de las condiciones de ensayo como las de control. Antes, un investigador necesitaba procesar manualmente imágenes a partir del ensayo de migración en el punto de tiempo correcto, con el fin de obtener los datos necesarios para la cuantificación y poder aplicarlos manualmente a su método de cuantificación.
En esta publicación, se expone el análisis de los efectos inhibidores en la migración celular del medicamento anticancerígeno sorafenib a través de la línea celular de cáncer de mama humano MCF7. También, se demuestra cómo puede automatizarse tanto el procesamiento de imágenes como la cuantificación en los ensayos de migración por medio del sistema de monitorización de incubación Provi™ CM20 de Olympus.
Procedimientos experimentales
Se cultivaron células MCF7 en el medio RPMI-1640, suplementado con suero fetal bovino (FBS) al 10 % y la combinación penicilina-estreptomicina al 1 %. Las células fueron cultivadas en una placa de 24 pocillos usando una inserción de cultivo Ibidi de dos pocillos (ibidi, Cat. N.º ib80209) bajo una densidad de 105,000 células/70 μL/cámara. La inserción Ibidi de dos pocillos fue retirada después de 24 horas de cultivo, lo que creó un espacio para la migración celular. Las células fueron lavadas tres veces y tratadas con sorafenib (10 o 30 μM), o fueron dejadas como controles sin tratar. El monitor CM20 capturó automáticamente imágenes a partir de las células a cada hora durante un máximo de 94 horas, con el fin de cuantificar la confluencia para la evaluación de la migración celular.
Resultados
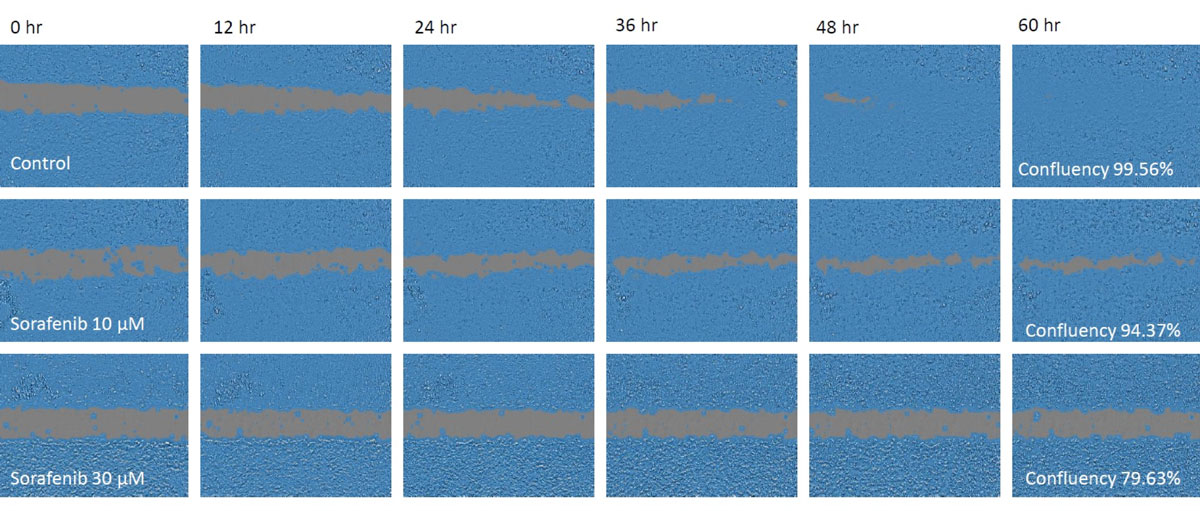
Figura 1. Imágenes de células durante un ensayo de migración
Arriba: control. Centro: sorafenib 10 μM. Abajo: sorafenib 30 μM. Las áreas ocultas indican áreas confluentes detectadas automáticamente por el monitor CM20.
La migración celular se redujo en ambos grupos tratados con sorafenib, en relación proporcional con la concentración de sorafenib, y aún estaba abierta tras 48 horas, mientras que el control ya estaba cerrado en este punto de tiempo.
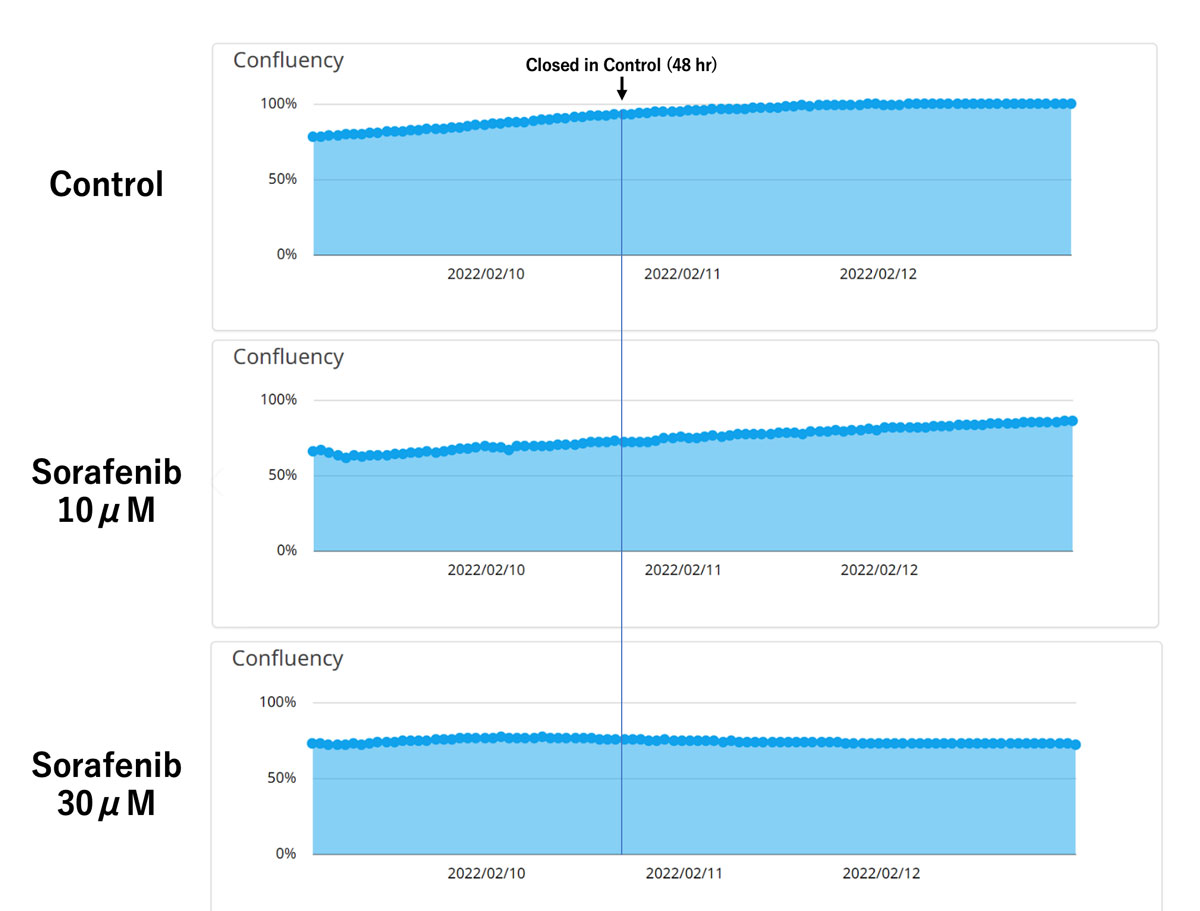
Figura 2. Cuantificación de la confluencia en un ensayo de migración.
Arriba: control. Centro: sorafenib 10 μM. Abajo: sorafenib 30 μM.
La cuantificación de la confluencia por medio del monitor CM20 mostró concordancia con los resultados obtenidos a partir de las observaciones celulares. Las células de control mostraron casi un 100 % de confluencia a las 48 horas, mientras que las células tratadas con sorafenib mostraron una menor confluencia en relación proporcional con la concentración de sorafenib.
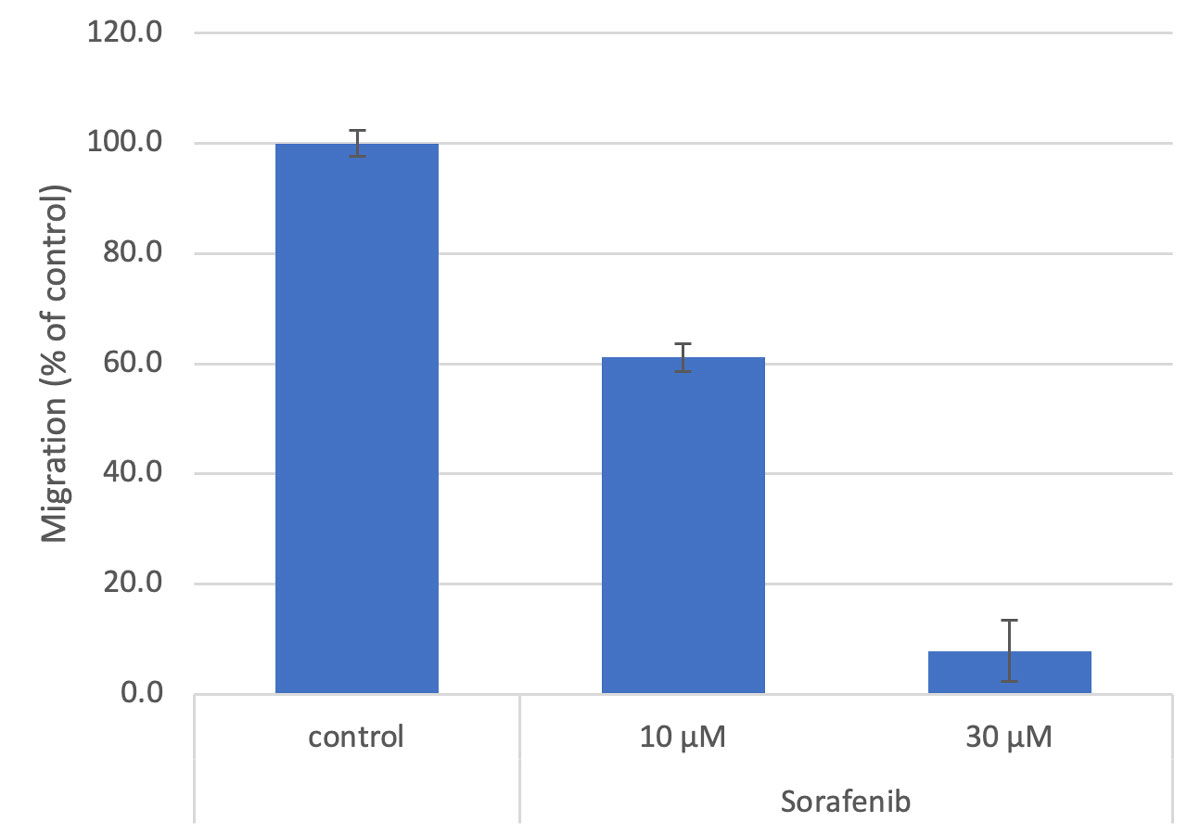
Figura 3. Cuantificación del cierre en relación con el control en 48 horas.
Bar = medio ± SE, n=3
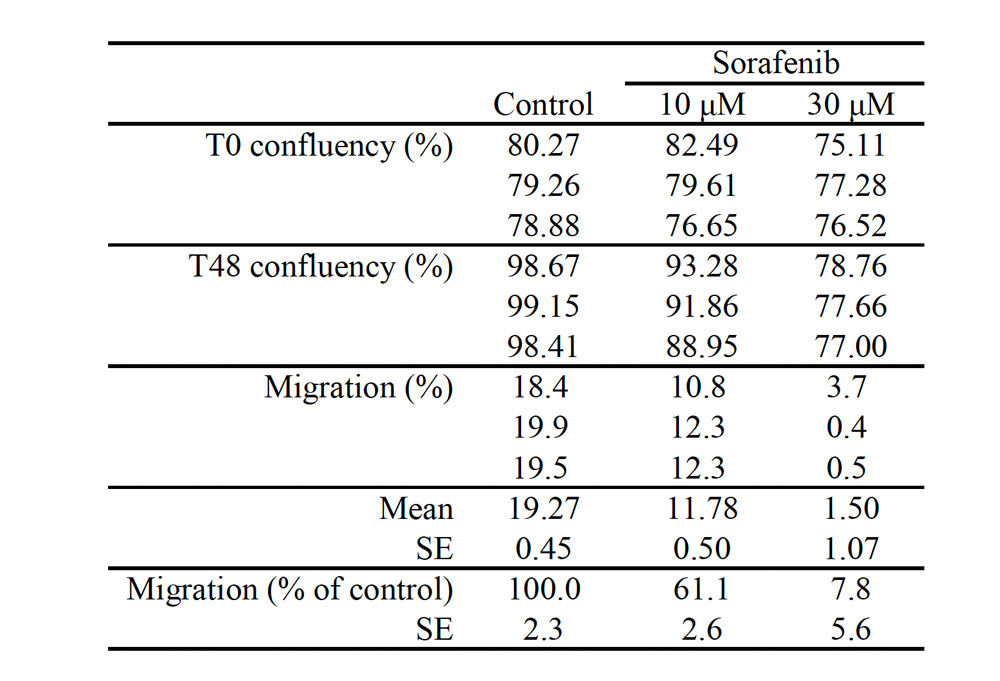
Tabla 1. Cuantificación de la migración celular en un ensayo de migración.
La migración celular se determinó por medio de la sustracción de los niveles de confluencia al inicio del tratamiento desde aquellos posteriores a los tratamientos de 48 horas. Se halló que la migración celular estaba significativamente inhibida en proporción a las concentraciones de sorafenib.
Beneficios de las evaluaciones con el sistema de monitorización de incubación
Los efectos inhibidores de migración celular del medicamento anticancerígeno han podido ser detectados de manera efectiva a través de un ensayo de migración que usa el sistema de monitorización de incubación CM20.
Poder determinar el tiempo de medición apropiado es esencial en un ensayo de migración. Los efectos de los medicamentos pueden detectarse mejor cuando son evaluados en el momento que se completa la migración con respecto a la condición más rápida (es decir, al grupo de control en este análisis). Antes, era necesario observar las células cada ciertas horas para verificar la migración; por consiguiente, planificar los experimentos giraba en torno a la disponibilidad del investigador. Aun entonces, podía existir el riesgo que una migración se complete durante la noche. Sin embargo, el monitor CM20 resuelve este problema al generar imágenes y cuantificar automáticamente la migración celular a medida que transcurre el tiempo. El sistema permite al usuario analizar las células según resulte mejor, lo que mejora en gran medida la eficiencia de la distribución del trabajo. Usar un sistema de monitorización de incubación para experimentos de migración ofrece la posibilidad a los investigadores de ahorrar tiempo, mejorar la precisión y la uniformidad, así como llevar a cabo ensayos más exitosos.
Reconocimientos
Esta nota de aplicación se ha elaborado con la ayuda del siguiente investigador:
Dr. Takahiro Yamaguchi, Investigador Principal, ACEL, Inc.
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.