Gestochen scharfe Bilder von dicken Proben durch die optische SILA-Schnittmethode
In der Forschung werden Objektträgerscanner wegen ihrer kompakten Bauweise und ihres breiten Einsatzspektrums immer häufiger eingesetzt. Zu den leistungsfähigsten Anwendungen zählt die Kombination mit Weitfeld-Fluoreszenzmikroskopie (WF) zur Erkennung von Fluoreszenz in dünnen Proben. Für Anwendungen in dicken Proben stellt die Speckle Illumination Acquisition (SILA) eine effiziente Bildverarbeitungsmethode dar. In Kombination mit unserem SLIDEVIEW VS200 Objektträgerscanner für die Forschung liefert die SILA-Bildverarbeitung schnelle optische Schnitte digitaler Objektträgerbilder. Mit dieser Methode wird gestreutes Licht aus dicken Proben entfernt und der Kontrast erheblich verbessert.
Grenzen der Weitfeld-Fluoreszenzmikroskopie
Die WF-Mikroskopie ist ein bildgebendes Verfahren, bei dem ein relativ großer Bereich einer Probe mit dem Licht einer bestimmten Anregungswellenlänge beleuchtet wird. Dabei werden fluoreszenzaktive Moleküle im Probenvolumen verteilt und an bestimmten Stellen gebunden, ein Vorgang, der als Fluoreszenzfärbung bezeichnet wird. Diese Moleküle absorbieren die Anregungswellenlänge und geben anschließend Licht einer längeren Wellenlänge ab, das von einer Kamera erfasst wird.
Das von der Kamera erfasste Signal stammt von allen Molekülen in der Probe, die das Anregungslicht in ausreichender Stärke erreicht hat. Daher werden die feinen fluoreszierenden Strukturen in der Fokusebene durch das vorhandene gestreute Licht unscharf wiedergegeben. Die Lösung für dieses Problem ist die Anwendung optischer Schnittmethoden, die kontrastreiche und scharfe Bilder erzeugen.
Einführung der SPARQ Technologie für schnelle optische Schnitte
Bei der SILA-Bildverarbeitung wird die SPARQ Technologie (entwickelt von Bliq Photonics) verwendet, bei der ein HiLo-Algorithmus1 und ein Speckle-Scrambler für schnelle optische Schnitte kombiniert werden. Diese Technologie ermöglicht die Entfernung von gestreutem Licht aus Weitfeldaufnahmen, wodurch eine ähnliche Leistung wie bei der konfokalen Mikroskopie erreicht wird. 1-3
Diese Technologie setzt voraus, dass zwei Bilder der Probe aufgenommen werden: eines mit gleichmäßiger Beleuchtung und eines mit räumlich strukturierter Beleuchtung durch stochastische Laserspeckles auf der Probe. Die beiden erfassten Bilder werden im Rechner kombiniert, um ein scharfes Bild zu erzeugen. Der Übergang zwischen den beiden Bildzuständen erfolgt mit Hilfe des Speckle Scramblers (Abbildung 1).

Abbildung 1. Erfassung eines SILA-Bildes.
1. Gleichmäßige Beleuchtung
Das gleichmäßig beleuchtete Bild enthält Signale von Objekten, die im und außerhalb des Fokus liegen. Der Bildinhalt außerhalb des Fokus erscheint unscharf und enthält daher nur Komponenten mit niedriger Ortsfrequenz. Die Anwendung eines einfachen Hochpassfilters auf das einheitlich ausgeleuchtete Bild würde den unscharfen Inhalt herausfiltern und das einheitlich ausgeleuchtete Hochfrequenzbild im Fokus belassen. Dies hätte aber den unerwünschten Effekt, dass die niedrigen Ortsfrequenzen in der Fokusebene unterdrückt würden.
Um den niederfrequenten Inhalt der Probe in der Fokusebene wiederherzustellen, wird das Bild mit hochfrequenter strukturierter Beleuchtung (erzeugt durch die Speckles) aufgenommen und verarbeitet. Auf diese Weise ist es möglich, das niederfrequente Signal wiederherzustellen und von dem Signal zu unterscheiden, das nur aus der relevanten Ebene stammt.
2. Speckle-Beleuchtung
Speckles sind zufällige Fluktuationen durch diffuse Reflexionen oder Streuungen an Unregelmäßigkeiten im Medium, die für kohärente Lichtquellen wie Laser charakteristisch sind. Die Interferenz dieser Reflexionen oder Streuungen erzeugt die körnigen, stochastischen Muster, die auf die Probe projiziert werden.4
Bei der Speckle-Beleuchtung wird eine hochfrequente Ortsmodulation auf die Probe angewendet. Ein wichtiges Merkmal dieser Beleuchtungsart ist, dass der Modulationskontrast auf die Fokusebene des Mikroskopiesystems beschränkt ist. Durch die Messung des lokalen Kontrasts der Bildmodulation lässt sich daher feststellen, inwieweit das Objekt fokussiert ist bzw. fokussierte Anteile enthält.
3. Kombination beider Bilder
Aus dem Bild mit gleichmäßiger Beleuchtung werden mithilfe eines Hochpassfilters die hohen Frequenzen der Fokusebene extrahiert. Durch Messung des lokalen Kontrasts wird aus dem Speckle-Beleuchtungsbild ermittelt, inwieweit das Objekt im Fokus ist oder unscharfe Anteile enthält. Durch Anwendung eines Tiefpassfilters auf das Bild der lokalen Kontrastmessung erhält man das niederfrequente fokussierte Signal.
Durch die richtige Einstellung des Hoch- und Tiefpassfilters kann der aus dem Speckle-Beleuchtungsbild gewonnene niederfrequente fokussierte Bildanteil den aus dem gleichmäßigen Beleuchtungsbild gewonnenen hochfrequenten fokussierten Anteil ergänzen. Die Zusammenführung der hoch- und niederfrequenten Bildinhalte ergibt ein fokussiertes Bild mit voller Auflösung, das alle Frequenzkomponenten innerhalb der Frequenzbandbreite des Bildgebungssystems enthält (Abbildung 2).1-3

Abbildung 2. Schema der SILA-Verarbeitung
Interessanterweise ist es auch möglich, den Grad der optischen Schnitte zu verändern, indem der Parameter Schnittdicke (ST) verändert wird. Die Erhöhung des ST-Parameters ist vergleichbar mit der Vergrößerung der Lochblende eines konfokalen Mikroskops.
Eine Erhöhung des ST-Wertes ermöglicht die Einbeziehung eines größeren Spektralkontrastbereichs (d. h. eines größeren Signalvolumens) bei der SILA-Bildverarbeitung. Die Gesamtintensität nimmt zu und das Signal-Rausch-Verhältnis (SNR) ändert sich entsprechend. Wie bei der Lochblenden-Analogie, bei der die Signalverstärkung auf die -Bündelung außerhalb der Brennebene zurückzuführen ist, führt die ST-Erhöhung jedoch zu einem SILA-Bild mit suboptimalem optischem Schnitt.
Beispiel eines Versuchsergebnisses mit der SILA-Methode zur Herstellung optischer Schnitte
Ein 16 µm Kryostatschnitt einer Mausniere (mit FluoCells vorbereiteter Objektträger 3, F24630) mit WF- und SILA-Bildbeleuchtung Der ST-Parameter wurde auf 2 gesetzt (VS200 Scanner, UPLSAPO40XS Objektiv, 1,25 NA, 300 µm AA, Hamamatsu ORCA-Fusion Kamera). Diese Einstellung wurde unter Berücksichtigung der Probendicke als optimaler Parameter für die Beleuchtung gewählt. Ein zu kleiner ST-Parameter kann dazu führen, dass das erzeugte SILA-Bild aufgrund der stochastischen Natur der Speckles körnig wird.5
Die für die Aufnahme verwendete Anregungswellenlänge betrug 488 nm. Es wurden ein dichroitischer Multibandspiegel (für DAPI, FITC, Cy3 und Cy5) und ein einzelner Emissionsfilter für Fluoresceinisothiocyanat (FITC) verwendet. Die Belichtungszeit der Kamera wurde auf 60 ms eingestellt. Abbildung 3a zeigt das WF-Bild, Abbildung 3b zeigt dieselbe Region mit SILA-Bildgebung, wobei der ST-Wert an derselben Z-Position auf 2 eingestellt ist. In der gesamten Probe ist ein verbesserter Kontrast zu erkennen. Vor allem in den Bereichen 1-4 zeigen SILA-Bilder deutlich mehr Details als die WF-Methode.
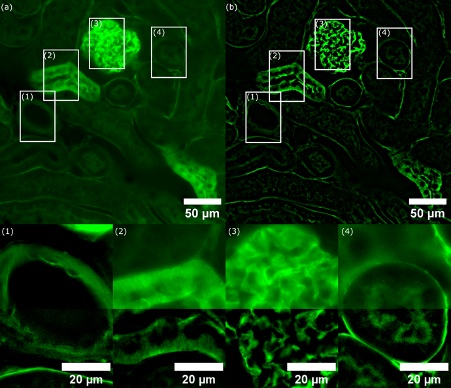
Abbildung 3: (a) WF-Bild einer mit Alexa Fluor 488 Weizenkeim-Agglutinin (W-11261) gefärbten Mausniere Weiße Rechtecke markieren die vier interessierenden Regionen (ROIs 1-4) der verglichenen Strukturen. (b) Optisches SILA-Schnittbild mit einem ST-Parameter von 2 (entspricht einem Wert von 6,803 µm). Die Bildeinschübe zeigen die vergrößerten ROIs (1-4) mit für die WF- und SILA-Bildgebung zusammengeführten Kanälen (obere Hälfte: WF, untere Hälfte: SILA). Der Bildkontrast mit SILA-Bildgebung ist deutlich besser. Dagegen sind im WF-Bild einige Strukturen kaum erkennbar. Es sei darauf hingewiesen, dass die detaillierten ROIs mit unterschiedlichen Intensitätsskalen dargestellt sind, um die aufgelösten Detailstrukturen zu demonstrieren.
Optisches Design des SILA-Bildgebungssystems
Das optische SILA-Schnittmodul basiert auf einem Weitfeld-Objektträgerscanner (unserem VS200 System), wobei die normale Fluoreszenzlichtquelle durch eine kohärente Lichtquelle ersetzt wurde. Das Licht wird durch Laserdioden erzeugt, die an eine Singlemode-Faser gekoppelt sind. Die im Singlemode gekoppelte Laserquelle wird durch die Speckle-Scrambler-Einheit projiziert. Diese erzeugt Speckles für die strukturierte Beleuchtung auf der Probenebene und entfernt Speckles für gleichmäßige Beleuchtung. Durch die präzise Steuerung der Laserbeleuchtung und der Scrambler-Einheit werden die einzelnen SILA-Bilder berechnet und zu einem optisch geschnittenen, vollständigen Objektträgerbild zusammengefügt.

Abbildung 4: Schema der SILA-Konstruktion mit kohärenter Lichtquelle, Speckle-Scrambler zur gleichmäßigen oder Speckle-Beleuchtung, optischem Pfad mit einem Objektiv, welches das Licht in die Probe leitet und das emittierte Licht bündelt, und einer Kamera als Lichtdetektor.
Qualitätsmessungen
1. Scanzeit
Die Scanzeit der SILA-Bildgebung wurde an kleinen Flächen von 5 × 5 mm getestet. Obwohl wir für jedes Kamera-Sichtfeld ein Bildpaar aufgenommen haben, verdoppelt sich die Erfassungszeit der SILA-Bilder im Vergleich zu WF-Bildern nicht. So erhöht sich die Erfassungszeit für das 40X Luftobjektiv nur um 53 %. Weitere Ergebnisse sind in Tabelle 1 dargestellt.
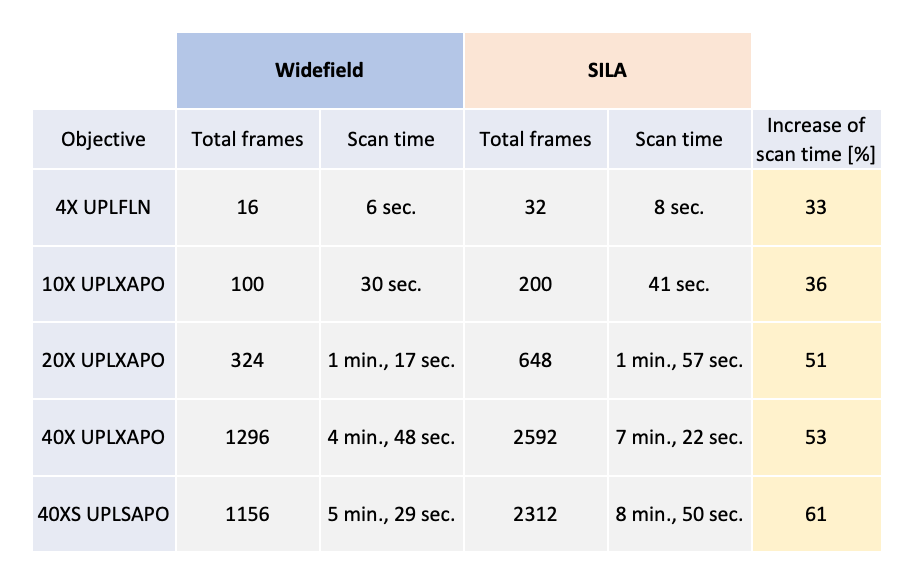
Tabelle 1: Aufgezeichnete Scanzeitwerte für WF- und SILA-Bilder, aufgenommen mit einer ORCA-Fusion Kamera (Hamamatsu Photonics) mit 4 Kanälen (DAPI, FITC, CY3, CY5) und einer Belichtung von 50 ms für einen Scanbereich von 5 × 5 mm. Der Anstieg der Scanzeit wird für jede Vergrößerung einzeln berechnet.
2. Auflösung
Die optische Auflösung der SILA-Bilder ist die gleiche wie bei den WF-Bildern. Die theoretische Auflösung für Objektive mit einer hohen NA wurde mit 0,2 µm in lateraler Richtung und 0,45 µm in axialer Richtung simuliert. Die experimentellen Werte der Punktspreizungsfunktion (PSF) wurden mit einem Ölimmersionsobjektiv (UPLXAPO100XO, 1,45 NA) und einer Probe gemessen mit Fluoreszenzbeads (TetraSpeck Microspheres, 0,1 µm, blau/grün/orange/dunkelrot fluoreszierend) mit einer Emissionswellenlänge von 520 nm gemessen. Die volle Breite bei halbem Maximum (FWHM) beträgt für WF-Bilder 0,22 µm in lateraler Richtung und 0,47 µm in axialer Richtung. Wir konnten bestätigen, dass die theoretisch berechneten Werte mit den experimentell gemessenen PSFs bei sehr kleinen Beads übereinstimmen.
3. Optische Schnittmöglichkeit
Die Stärke der SILA-Bildgebung liegt in ihrer Möglichkeit, optische Schnitte durchzuführen. Abbildung 5a-d zeigt ein Beispiel für eine Unterregion der Mäusenieren aus Abbildung 3 mit verschiedenen ST-Parametern; entsprechende orthogonale Ansichten sind in Abbildung 5e-h gezeigt. Die gesamte Probe wurde in Form eines Z-Stapels von 39 Bildern mit einem Z-Abstand von 0,34 µm aufgenommen. Mit abnehmendem ST-Wert nimmt der Kontrast zwischen den Strukturen und dem Hintergrund zu (Abbildung 5i). Zudem lassen sich detaillierte Strukturen leichter erkennen.
Zur Veranschaulichung haben wir für jeden ST-Parameter und für das WF-Bild ein Linienprofil in X-Richtung eines Z-Abschnitts an genau der gleichen Stelle aufgezeichnet. Der Vergleich der normalisierten Linienprofile zeigt deutlich, dass die Details bei der SILA-Bildgebung im Vergleich zu einem typischen WF-System stärker hervortreten. Die Intensitätsspitzen für die Strukturen sind höher als die Intensität des Hintergrunds und werden mit abnehmendem ST-Parameter schmaler.
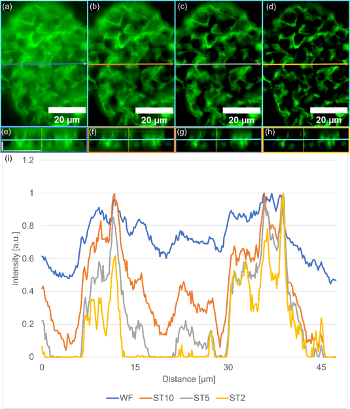
Abbildung 5: Verbesserung optischer Schnitte bei SILA-Beleuchtung gegenüber der Weitfeldbildgebung. (a) WF-Beleuchtung, (b) SILA-Beleuchtung mit ST10, (c) SILA mit ST5 und (d) SILA mit ST2. In jedem Bild markiert ein Pfeil die Messung des Linienprofils und die Position für die orthogonale Ansichtsebene in X-Richtung (e-h). Die SILA-Bilder mit verschiedenen ST-Parametern und die jeweiligen WF-Bilder werden als Z-Stapel aufgenommen, auch die orthogonale Ansicht in X-Richtung. Die blauen Linien zeigen die gleiche Z-Ebene wie in a-d. Die horizontale Maßstabsleiste entspricht 20 µm, die vertikale Maßstabsleiste 5 µm und gilt für alle Teilbilder. (i) Aufgezeichnete Linienprofile sind in a-b dargestellt. Zum Vergleich ist WF blau, SILA mit ST10 orange, SILA mit ST5 grau und SILA mit ST2 gelb dargestellt. Alle Diagramme sind auf 1 normiert. Der Kontrast wird besser, wenn der ST-Parameter verringert wird.
4. Schärfentiefe
Die optische SILA-Schnittmethode ermöglicht die Abbildung von Proben mit einer Dicke von mehreren hundert Mikrometern und mehr. Insbesondere bei geklärten Proben wird die Eindringtiefe der SILA-Bildgebung nur durch den Arbeitsabstand des Objektivs begrenzt. Bei ungeklärten Proben kann Licht durch die Probenstrukturen gestreut werden, sodass die tieferen Zellschichten schlecht erreicht werden.6
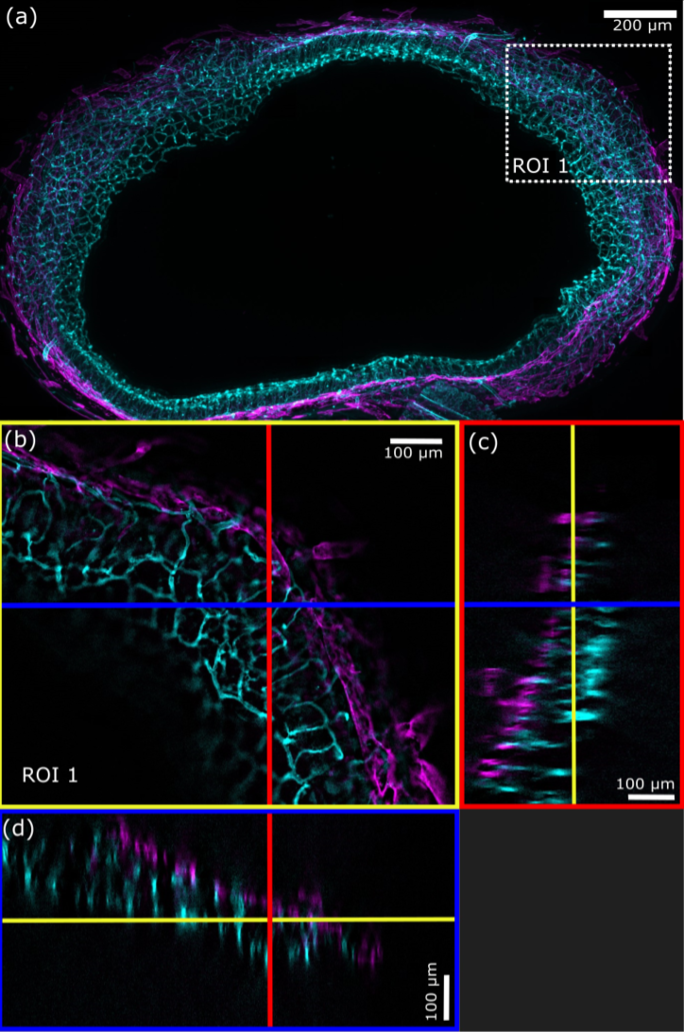
Abbildung 6. a) Maximale Intensitätsprojektion (MPI, 188 Ebenen, Z-Abstand = 2,36 μm) einer SILA-Aufnahme (ST = 2) des Mausdarms zeigt Blutgefäße (cyan) und Lymphgefäße (magenta). b) Das weiße gestrichelte Quadrat zeigt den vergrößerten ROI 1 aus (a), die blaue Linie markiert die Position der orthogonalen XZ-Ansicht und die rote Linie die Position der orthogonalen YZ-Ansicht. c) Das blaue Rechteck zeigt die orthogonale Ansicht in YZ-Richtung und d) das rote Rechteck die orthogonale Ansicht in XZ-Richtung. Die gelben Linien zeigen die in (b) dargestellte Z-Ebene. (FluoTissue 450 μm Mausdarmschnitt, Sun Jin Labor) verarbeitet mit RapiClear 1.52).
5. Wiederholbarkeit
Die SILA-Bildverarbeitung ermöglicht die Berechnung eines Bildes mit einem optischen Schnitt aus einem einheitlich beleuchteten und einem Speckle-Bild. Im Idealfall wird die Speckle-Struktur vollständig herausgefiltert und ist im endgültigen SILA-Bild nicht mehr zu erkennen. Dies ist jedoch nicht der Fall. Die Speckle-Beleuchtung führt naturgemäß zu einer leichten Veränderung der Signalintensität. So kann zum Beispiel in einem Bild ein Speckle ein Probendetail beleuchten, das in einem anderen Bild nicht beleuchtet wird. Dieses Phänomen erklärt die im endgültigen Bild zu beobachtenden verbleibenden Intensitätsschwankungen. Diese Schwankung ist per Definition stochastisch und stellt eine Stärke (optischer Schnitt und Eindringtiefe) und eine Einschränkung der Technik (Schwankung der Signalintensität) dar.
Um die Variation der Signalintensität zu untersuchen, wurde eine Sequenz von 10 Scans (Abbildung 7) für vier verschiedene ST-Parameter aufgenommen (Abbildung 8a). Für jede Probe wurde der Variationskoeffizient (CV) über 90 willkürlich gewählte ROIs mit Strukturen zur Quantifizierung der Intensitätsschwankungen während der gesamten Scan-Sequenz berechnet:
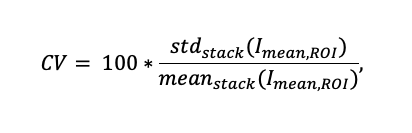
Dabei ist Imean,ROI die mittlere Fluoreszenzintensität einer ROI für einen einzelnen Scan. stdstack und meanstack sind die Standardabweichung bzw. der Mittelwert des Imean,ROI für die gesamte Sequenz von 10 Scans. Abbildung 7c zeigt ein Beispiel mit 25 ROIs und deren mittlere Fluoreszenzintensitätsprofile für diese 10 Scans.
Der für drei verschiedene Proben berechnete CV für Bereiche mit Strukturen nimmt je nach ST ab (Abbildung 8b); bei einem größeren Wert des Schnittparameters ist die räumliche Filterung des Speckle-Bildes schwächer, was zu geringeren Intensitätsschwankungen auf den SILA-Bildern führt. Der Variationskoeffizient für SILA-Bilder, die an 3 verschiedenen Strukturen mit 90 erkannten ROIs gemessen wurden, beträgt im Durchschnitt 3,7 ± 1,4 %. Zum Vergleich: Die Schwankung der Signalintensität im WF-Modus beträgt etwa 0,3 % und ist systemimmanent.
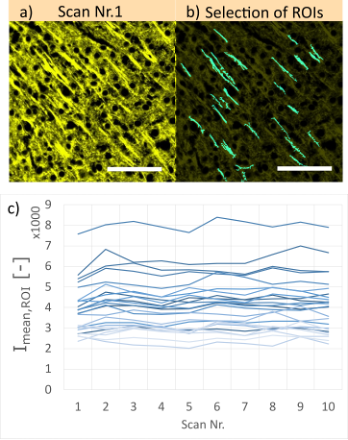
Abbildung 7. a) Beispiel einer Mausgehirnprobe (mit Cy3 gefärbt, 100 µm dick), aufgenommen mit SILA-Bildgebung mit einem ST-Wert von 10 bei 40-facher Vergrößerung. Jeder Bereich wurde 10-mal in derselben Fokusebene gescannt. b) Cyanfarbene interessierende Bereiche (ROIs) zeigen die ausgewählten Strukturen für unsere Messungen der mittleren Fluoreszenzintensität (Imean,ROI). Die Maßstabsleisten entsprechen 50 µm. c) Die mittleren Intensitätsprofile der zuvor gezeigten, ausgewählten ROIs. Jede Linie entspricht einer ROI. Zur Verdeutlichung ist nur ein kleiner Ausschnitt des Bildes mit 25 ROIs gezeigt.
Vergleich mit anderen optischen Schnittmethoden
In den folgenden Abbildungen wird die SILA-Bildgebung mit der regulären Weitfeldmikroskopie, Schärfungsalgorithmen, Dekonvolution und der konfokalen Laser-Scanning-Mikroskopie verglichen. Die SILA-Bildgebung ermöglicht eine enorme Verbesserung der optischen Schnitte und des Kontrasts im Vergleich zur herkömmlichen WF-Bildgebung mit einem Schärfungsalgorithmus. Gegenüber der Dekonvolution verbessert die SILA-Technologie die Bildqualität. Darüber hinaus reduzieren optische Schnitte die häufig mit der Aufnahme großer kompletter Objektträger verbundene lange Bearbeitungsdauer.
Im Vergleich mit der konfokalen Mikroskopie kommt die SILA-Technologie der konfokalen Mikroskopie in Bezug auf die Bildqualität erstaunlich nahe. Bei der Weitfeldmikroskopie ist erwartungsgemäß Hintergrundfluoreszenz vorhanden. Sowohl die konfokale Mikroskopie als auch die SILA-Mikroskopie erzeugen optische Schnittbilder mit viel höherem Kontrast und zeigen trotz der Streuung der Probe feine Details der zellulären Organisation. Zur Beurteilung der Bilddetails und der räumlichen Variationen der Intensitätsverteilung müssen weitere Vergleiche zwischen SILA und konfokaler Mikroskopie durchgeführt werden. Für eine qualitative Bewertung und für Kolokalisierungsstudien ist die SILA-Technologie jedoch ausreichend. SILA kann als schnelle Scannereinheit genutzt werden, um große Mengen an Proben zu sichten. Proben mit relevantenStrukturen können dann zur quantitativen Bildgebung im konfokalen Mikroskop untersucht werden.
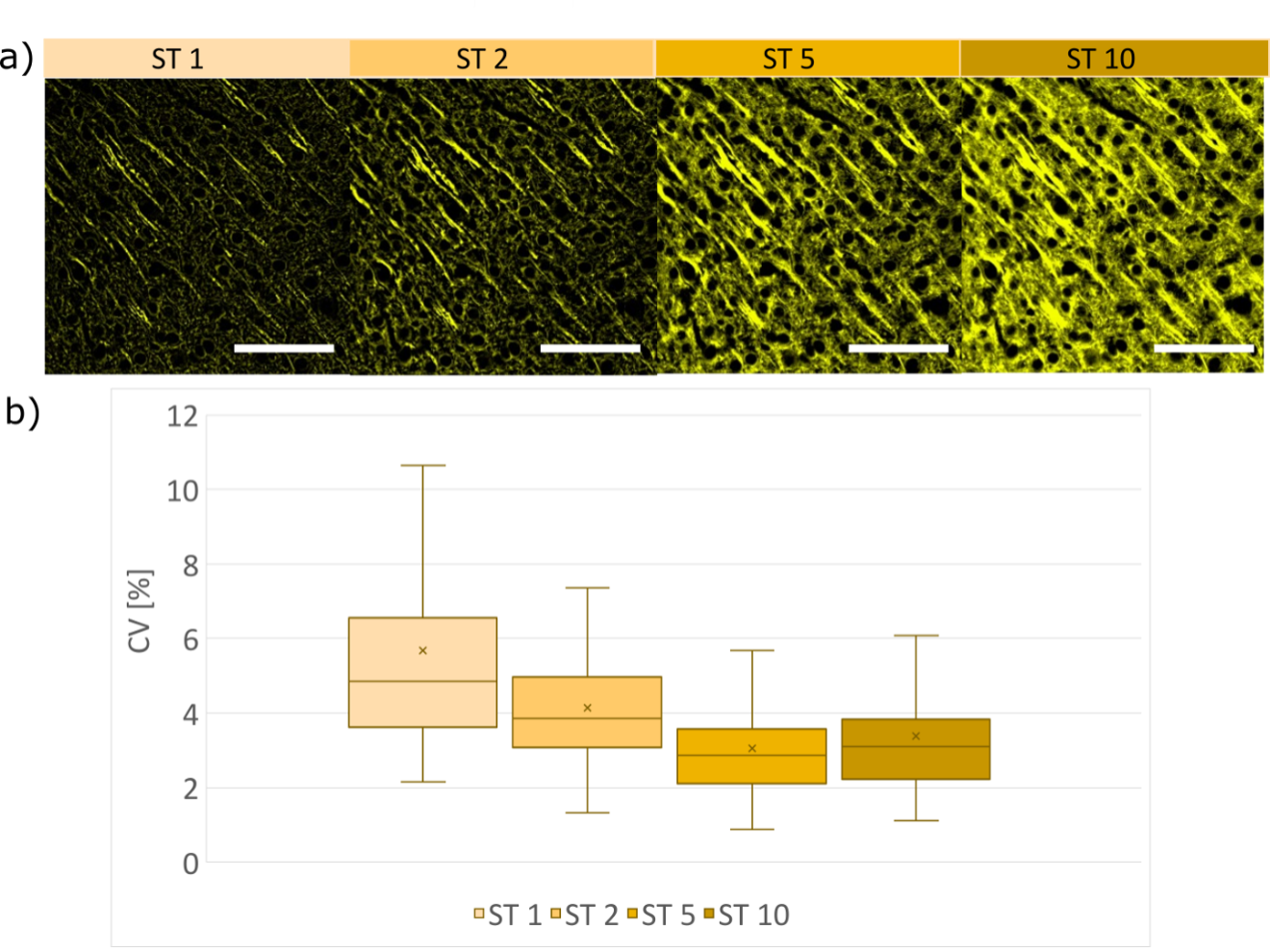
Abbildung 9: Bild eines Plattwurms, Schmidtea mediterranea (20X Objektiv). Es wurden drei Methoden verglichen: a) WF-Bild, b) WF-Bild mit einem Schärfungsalgorithmus und c) SILA-Bild mit einem ST-Parameter von 5. Blau: DAPI; Grün: innere Darmzellen. Rot: äußere Darmzellen. Bildquelle: Amrutha Palavalli, Abteilung für Gewebedynamik und Regeneration, Max-Planck-Institut für multidisziplinäre Naturwissenschaften, Göttingen, Deutschland. Die Maßstabsleiste entspricht 500 µm und gilt für alle Teilbilder.
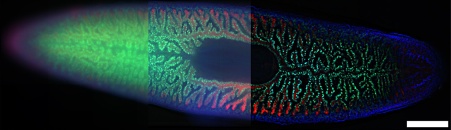
Abbildung 10: Bild eines mit MAP2 gefärbten dicken Mausgehirns (20X Objektiv). Es wurden drei Methoden verglichen: a) WF-Bild mit EFI-Projektion (erweiterter Fokusbereich), b) WF-Bild mit EFI-Projektion und angewandter Dekonvolution und c) SILA-Bild mit EFI-Projektion und einem ST-Parameter von 2. Die Maßstabsleisten entsprechen 50 µm.
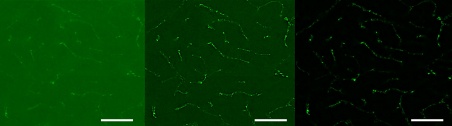
Abbildung 11: Bild einer Mausgehirnprobe mit Neuronen, die mit glial fibrillärem saurem Protein (GFAP) markiert sind (20X Objektiv). Es wurden drei Methoden verglichen: a) konfokales Bild, aufgenommen mit einem FLUOVIEW™-Mikroskop, b) dasselbe konfokale Bild mit zusätzlicher Dekonvolution und c) SILA-Bild mit einem ST-Parameter von 2. Die Maßstabsleiste entspricht 50 µm und gilt für alle Teilbilder.
Zusammenfassung
Mit dem SILA-Modul zur Erstellung von optischen Schnitten für den VS200 Scanner lassen sich Bilder mit verbessertem Kontrast für dickere Proben erzielen. Gegenüber der WF-Mikroskopie erhöht sich die Scanzeit bei Verwendung des 40X Luftobjektivs im Durchschnitt um 53 %. Die erreichbare optische Tiefe ist nur durch den Arbeitsabstand des optischen Aufbaus begrenzt, wie durch das Scannen sehr dicker Proben (mit einer Dicke von bis zu 500 μm) bestätigt wurde. Die axiale Auflösung bei der SILA-Technik ist gleich wie bei der WF-Bildgebung, aber die optischen Schnitte sind wesentlich besser und können über den Parameter für die Schnittdicke gesteuert werden.
Bei einem größeren Wert des ST-Parameters ist die Stärke der räumlichen Filterung auf dem Speckle-Bild schwächer. Dadurch sind die Intensitätsschwankungen auf den SILA-Bildern geringer, bei unseren Beispielen im Durchschnitt 3,7 ± 1,4 %. Die höhere Intensitätsabweichung von ST-Parameter 1 kann durch Erhöhung des ST-Parameters begrenzt werden. Diese Anpassung sollte berücksichtigt werden, wenn eine quantitative Analyse der Fluoreszenzintensitäten erforderlich ist.
Das System ermöglicht es, schnell Bilder zu erhalten, die mit denen der konfokalen Mikroskopie oder der angewandten Dekonvolution vergleichbar sind. Unserer Ansicht nach kann diese Technologie gut zum schnellen Scannen dicker Objektträger eingesetzt werden. Vorteilhaft ist dabei, dass gestochen scharfe und kontrastreiche Bilder mit ausreichendem Detailfokus erhalten werden.
Literatur
- Lim, D., Ford, T., Chu, K.K., und Mertz, J. 2011. „Optically Sectioned In Vivo Imaging with Speckle Illumination HiLo Microscopy“ Journal of Biomedical Optics. 16, 016014.
- Lim, D., Chu, K.K., und Mertz, J. 2008. „Widefield Fluorescence Sectioning with Hybrid Speckle and Uniform-Illumination Microscopy“ Optical Letters. 33, 1819–1821.
- Mertz, J. und Kim, J. 2010. „Scanning Light-Sheet Mikroskopie im gesamten Maushirn mit HiLo Background Rejection“ J. Biomed. Opt. 15, 016027.
- 4. Goodman, J. W. 2007. „Speckle Phenomena in Optics: Theory and Applications“ Roberts and Company Publishers.
- Schniete, J., Franssen, A., Dempster, J. et al. 2018. „Fast Optical Sectioning for Widefield Fluorescence Mesoscopy with the Mesolens based on HiLo Microscopy“ Sci Rep, 8, 16259.
- Richardson, D. S. und Lichtman, J. W. 2015. „Clarifying Tissue Clearing“ Cell. 162.2: 246–257.
Autoren
Anna Zelená, Application Specialist, Evident Technology Center Europe
Wei Juan Wong, Product Manager, Evident Technology Center Europe
Gabriel Maranon, Product Expert, Bliq Photonics
Alicja Gąsecka, R& D und Production Director, Bliq Photonics
Mariêve Picard, Sales and Marketing Director, Bliq Photonics
Jeck Borne, Systems Engineer, Bliq Photonics
Ein Dankeschön an das gesamte VS200-Team im Evident Technology Center Europe.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.