Not Available in Your Country
Sorry, this page is not
available in your country.
- Überblick
- Angewandte Technologien
- KI-Lösungen für die Konfokalmikroskopie
- Konfigurationen
- Technische Angaben
- Informationsmaterialien
Überblick
Präzisionsbildgebung im WandelUnser FV4000 Mikroskop ist die Kulmination von mehr als 100 Jahren Erfahrung in der Optik – ein technologischer Durchbruch für Bilder in hervorragender Qualität, der die Möglichkeit eröffnet, Dinge aus einer anderen Perspektive zu sehen und die Forschung damit voranzubringen. |
 |
|
|---|
|
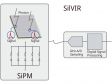
Bahnbrechende SilVIR Detektortechnologie: Der neue StandardMit unserem fortschrittlichen SilVIR Detektor auf Siliziumbasis ist die Erfassung präziser und reproduzierbarer Daten einfacher denn je. Der Detektor vereint in sich zwei hochmoderne Technologien – einen Silizium-Photomultiplier (SiPM) und unsere patentierte* schnelle Signalverarbeitung.
*Patentnummer US11237047
|
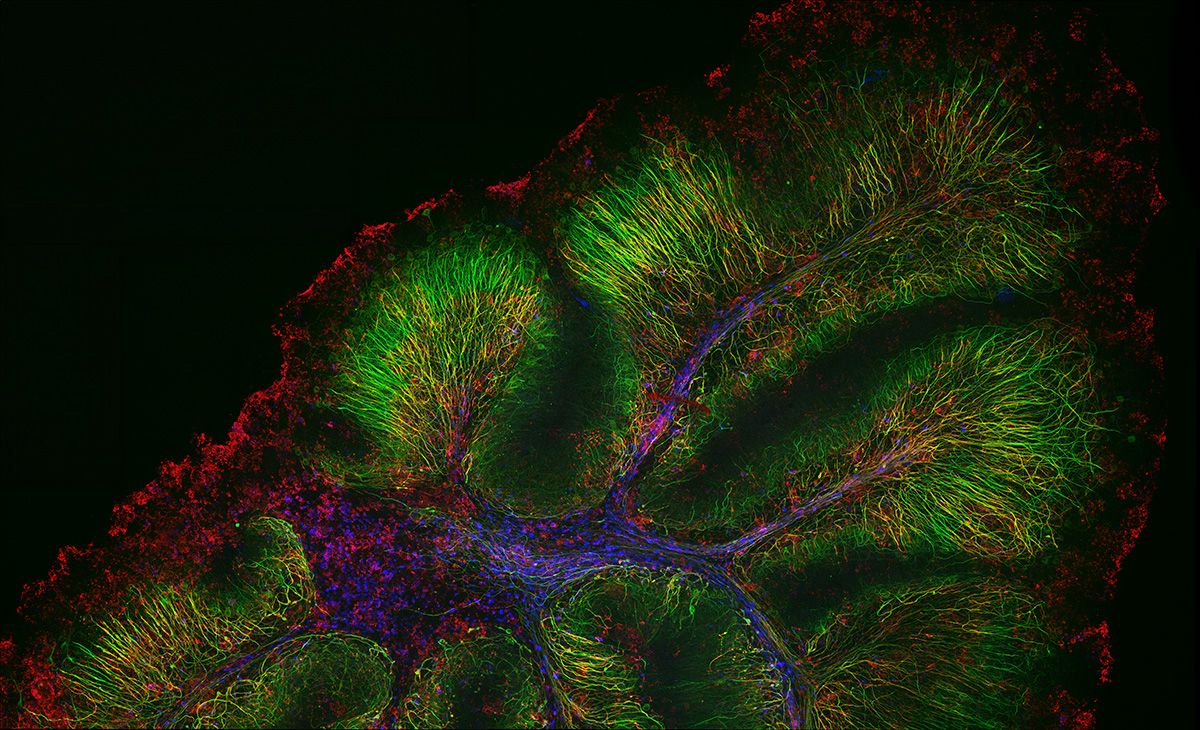
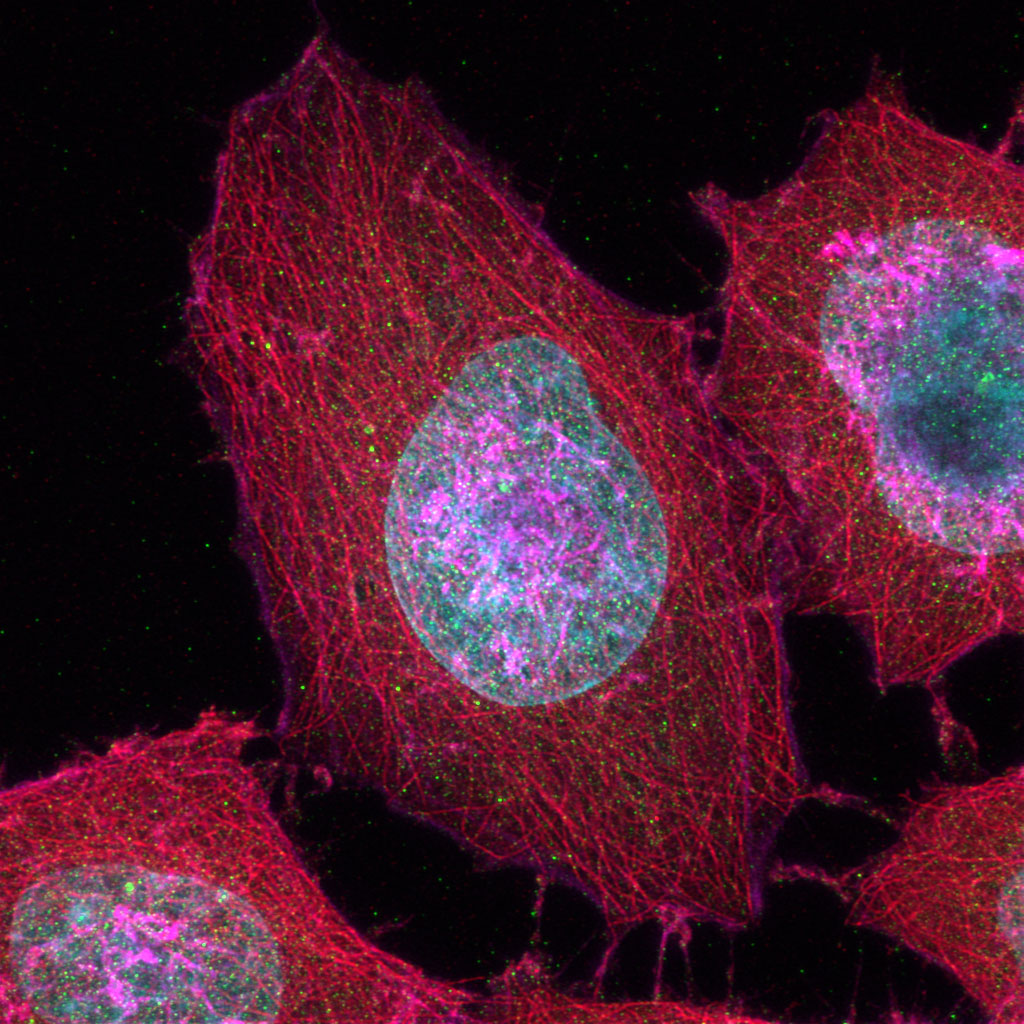
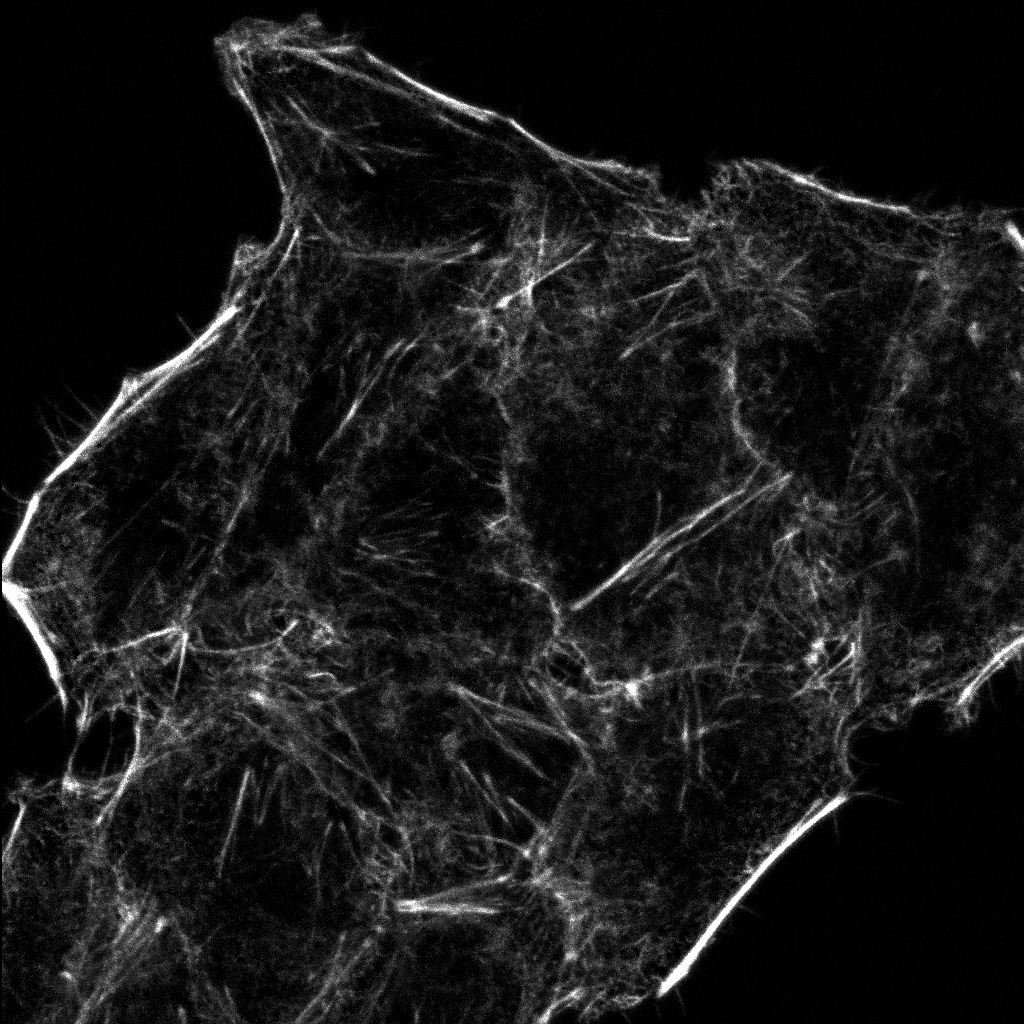
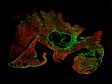
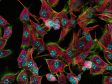
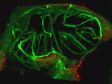
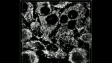
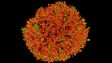
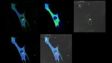
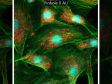
Schwere Neurofilament-Kette (NFH) in grün, basisches Myelinprotein (MBP) in rot, Glutathion-S-Transferase pi 1 (GSTpi) in blau. Kleinhirn einer Maus, aufgenommen mit einem UPLXAPO40X Objektiv.
|
|
|
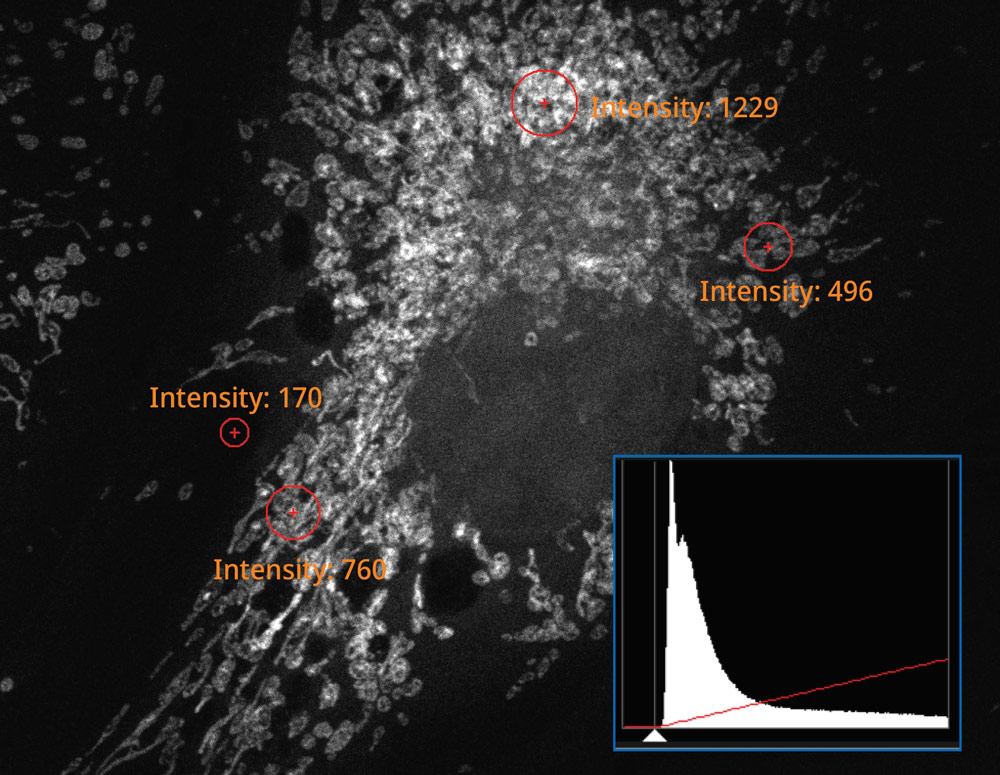
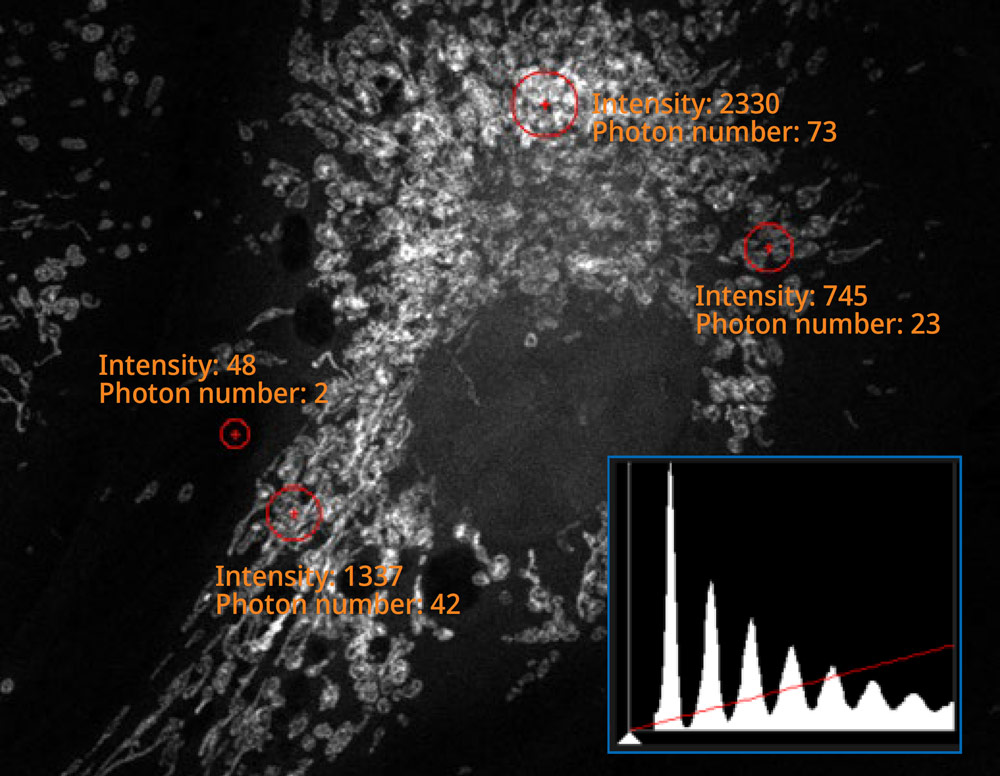
Das Histogramm des mit dem SilVIR Detektor erfassten Bildes zeigt ein schwaches Muster, wo die Intensität in die Photonenzahl umgewandelt werden kann. Die Fluoreszenzintensität des Detektors kann als Photonenzahl quantifiziert werden, und der Rauschpegel ist äußerst niedrig. | |
|
Mehr Informationen aus konfokalen BildernMit der aktualisierten TruSpectral Technologie des Systems und den hochempfindlichen SilVIR Detektoren ist ein Multiplexing von bis zu sechs bahnbrechenden Kanälen gleichzeitig möglich*. *Stand Oktober 2023.
|
Problemlose Anpassung an sich ändernde ForschungsanforderungenUnsere FV-Applikationen sind einzigartige Lösungen für das FV4000 Mikroskop mit höchstem Wert und Flexibilität.
| ||||
Gleichmäßigere Hochgeschwindigkeits-Zeitrafferaufnahmen konfokaler Bilder | |
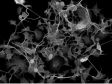
Related VideosHeLa-Zellen, markiert mit MitoView 720. XYZT-Bildgebung mit einem 1K-Resonanzscanner für 30 Minuten. | Zeitrafferaufnahmen werden durch intelligente Funktionen erleichtert:
|
Reproduzierbare Bilddaten trotz verschiedener Benutzer und SystemeDer SilVIR Detektor weist im Laufe der Zeit einen geringeren Empfindlichkeitsverlust auf als Detektor-Technologien der vorherigen Generation. Mit unserem Laser Power Monitor (LPM) und dem TruFocus Z-Drift-Kompensator lassen sich reproduzierbare Bilder unter konstanten Bedingungen erzielen. Verschiedene Benutzer können an verschiedenen Tagen mit denselben Einstellungen dieselben präzisen Bilder aufnehmen. Durch Verwendung derselben Photonenzahl-Intensitätsskala können selbst die von verschiedenen FV4000 Mikroskopen aufgenommenen Bilder verglichen werden. Zur weiteren Verbesserung der Reproduzierbarkeit ermöglicht der Microscope Performance Monitor eine Überprüfung der Laserleistung, der Detektionsempfindlichkeit und der optischen Leistung des Systems, damit das FV4000 Mikroskop konstant auf gleichbleibend hohem Niveau arbeitet. |
High-End-Bildgebung für die Forschung der ZukunftDas FV4000 Mikroskop ist so konzipiert, dass jeder Benutzer davon profitiert – vom Core Facility Manager bis hin zu denjenigen, die Bildgebungsexperimente am Mikroskop durchführen. Core-Facility-Manager
PI und Gruppenleiter
Einzelne Bediener
|
Zuverlässiger Support und Service für MikroskopeDas FV4000 ist ein wartungsfreundliches System:
Wir stehen hinter unseren Produkten und bemühen uns um schnellen Service und technische Unterstützung. Es sind verschiedene Support-Pläne erhältlich, damit das Mikroskop zu kalkulierbaren Kosten mit optimaler Leistung funktioniert. Außerdem bieten wir Fernunterstützung an*, sodass Benutzer bei Problemen nicht auf den Besuch eines Technikers oder Spezialisten warten müssen.
|
Benötigen Sie weitere Informationen? |
Angewandte Technologien
Tiefere Einblicke dank konfokaler Mikroskopie im NIR-SpektrumDie Nahinfrarot-Bildgebung (NIR) ist vollständig in das FV4000 integriert, und alle Detektoren arbeiten auch im NIR-Bereich, so dass sich die Vorteile dieser Bildgebungstechnik optimal nutzen lassen:
|
Preisgekrönte Technologie für preisgekrönte ForschungAlle optischen Elemente des FV4000 Systems haben eine hohe Transmission von 400 nm bis 1300 nm, auch das Galvanometer und der Resonanz-Scanner, die mit Silber statt wie üblich mit Aluminium beschichtet sind. Unsere preisgekrönten X Line Objektive sind im Hinblick auf chromatische Aberrationen zwischen 400 und 1000 nm korrigiert. Sie haben zudem eine höhere numerische Apertur, eine ausgezeichnete Planheit und eine sehr hohe Transmission vom UV- bis zum NIR-Spektrum, was die Multiplexing-Fähigkeiten verbessert. Unser spezielles A Line Ölimmersionsobjektiv (ne ~ 1,40) (PLAPON60XOSC2) reduziert die chromatische Aberration erheblich und verbessert so die Zuverlässigkeit und Genauigkeit der Co-Lokalisierung. |
|
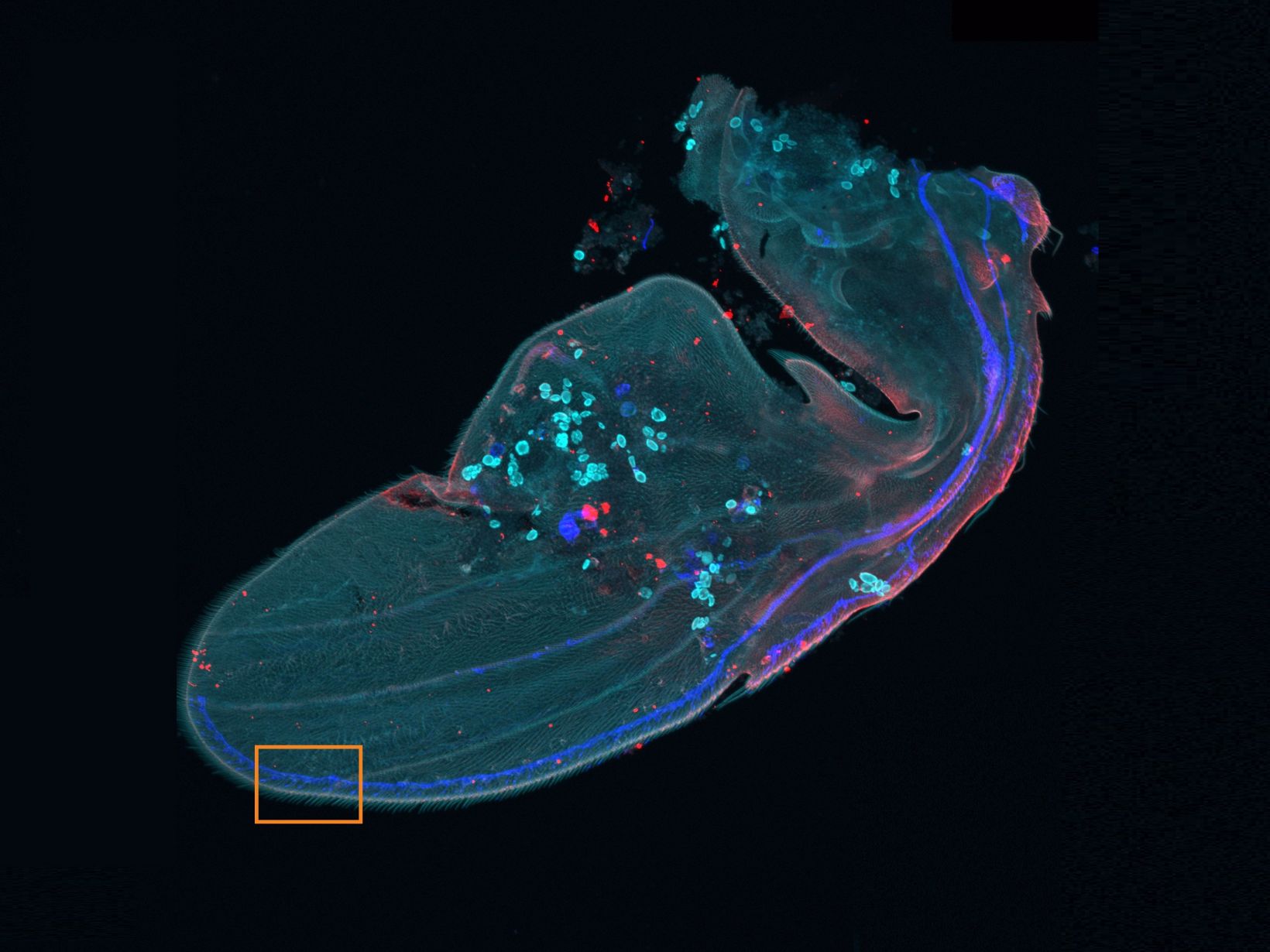
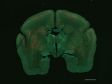
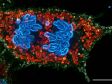
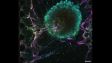
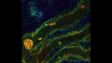
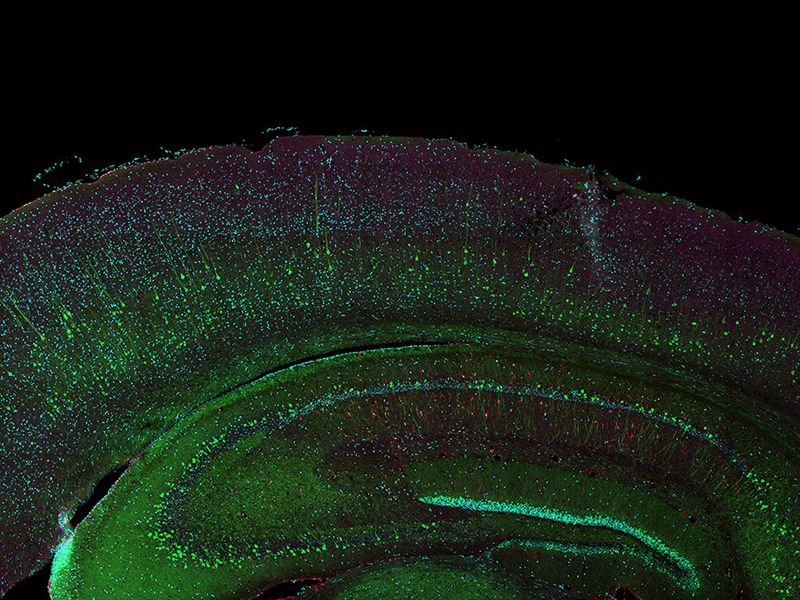  Es wurden insgesamt 77 Vierkanal-XYZ-Positionen (11 × 7) mit einem 1K-Resonanzscanner innerhalb von 16 Minuten aufgenommen, um das zusammengesetzte Bild zu erstellen. Mit einem Galvanometerscanner werden dafür sonst 2 Stunden benötigt. Der koronale Abschnitt des Gehirns einer Maus aus der H-Linie, cyan; DAPI (Zellkerne), grün; YFP (Neuron), gelb; Cy3-Astrozyten, magenta; AlexaFluor 750 (Mikrotubuli). Bildquelle: Takako Kogure und Atsushi Miyawaki, Cell Function Dynamics, RIKEN CBS. | Hochwertigere Bilder bis zu 60-mal schneller als mit dem FV3000 SystemEine einzigartige Kombination von Technologien liefert qualitativ hochwertige Bilder, und das bis zu 60-mal schneller als beim FV3000 Mikroskop.
|
|---|
8x schnelleres Super Resolution Imaging*Mit dem FV4000 Mikroskop können ohne zusätzliche Hardware Bilder mit Makro-, Mikro- und Superauflösung aufgenommen werden.
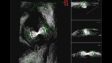
*Im Vergleich zum FV3000. |  Konfokaler Modus 1AU (links) im Vergleich zum Modus mit sehr hoher Auflösung (rechts) |
Für tiefere Einblicke mit hochauflösender 3D-Bildgebung | |
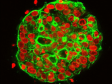
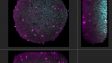
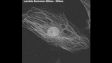
Related VideosHeLa-Zellsphäroid, markiert mit DAPI (cyan, Zellkerne) und AlexaFluor790 (magenta, Ki-67). Die Abbildung des gesamten Volumens des Sphäroids war mit NIR 785 nm möglich, wohingegen die Betrachtung nur von Zellkernen im Oberflächenbereich mit einem 405 nm-Laser möglich war. | Schnelle und einfache Erfassung von hochauflösenden 3D-Bildern von dicken Proben. Maximierte Tiefe, Zeit und Bildqualität
|
Präzise Dynamik lebender Zellen bei geringerer Schädigung
|
Klare Bilder selbst in tiefen EbenenBei Kombination des FV4000 Mikroskops mit unseren Silikon-Immersionsobjektiven lassen sich klare Bilder von Merkmalen und Strukturen auch in tiefen Probenebenen aufnehmen. Silikonöl hat einen ähnlichen Brechungsindex wie Lebendzellen oder Gewebe, wodurch die sphärische Aberration im Vergleich zu Luft, Wasser oder anderen Ölen stark reduziert wird. Dank der geringeren Aberration sind somit kontrastreichere Bilder tieferer Ebenen der Probe möglich. Silikon-Immersionsöl trocknet bei 37 °C nicht aus und ist daher speziell für Langzeit-Zeitrafferaufnahmen hervorragend geeignet. | Related Videos |
Benötigen Sie weitere Informationen? |
KI-Lösungen für die Konfokalmikroskopie
Beeindruckende, datenreiche Bilder in kürzerer Zeit und mit weniger AufwandErhalten Sie bessere Bilder in kürzerer Zeit und mit weniger Aufwand. Die TruAI Technologie zur Rauschunterdrückung reduziert die bereits rauscharmen Bilder des FV4000 System auf extrem niedrige Werte und liefert beeindruckende, datenreiche Resonanzbilder. Zur Beschleunigung der Bildanalyse kann ein KI-Modell vorab trainiert werden, sodass das System die Bilddaten automatisch segmentiert. So reduziert sich der Arbeitsaufwand bei diesem oft zeitaufwändigen manuellen Prozesses erheblich. Für schnelle Ergebnisse wird die Analyse dann mittels TruAI Technologie weiter optimiert. |
Wo Innovation auf herausragende Bildgebung trifftMit der TruAI Rauschunterdrückung lässt sich die Bildqualität des Resonanz-Scanners verbessern. Resonanzbilder können die Zelldynamik bei hohen Geschwindigkeiten mit geringen Schäden effektiv darstellen. Dabei sind allerdings in der Regel Kompromisse bezüglich des Signal-Rausch-Verhältnisses notwendig. Mit der TruAI Rauschunterdrückung lassen sich diese Bilder verbessern, ohne dass die zeitliche Auflösung beeinträchtigt wird. Dazu werden vortrainierte neuronale Netze verwendet, die auf dem Rauschmuster der SilVIR Detektoren basieren. Diese vortrainierten TruAI Rauschunterdrückungsalgorithmen können sowohl bei der direkten Verarbeitung als auch bei der Nachbearbeitung verwendet werden. | |
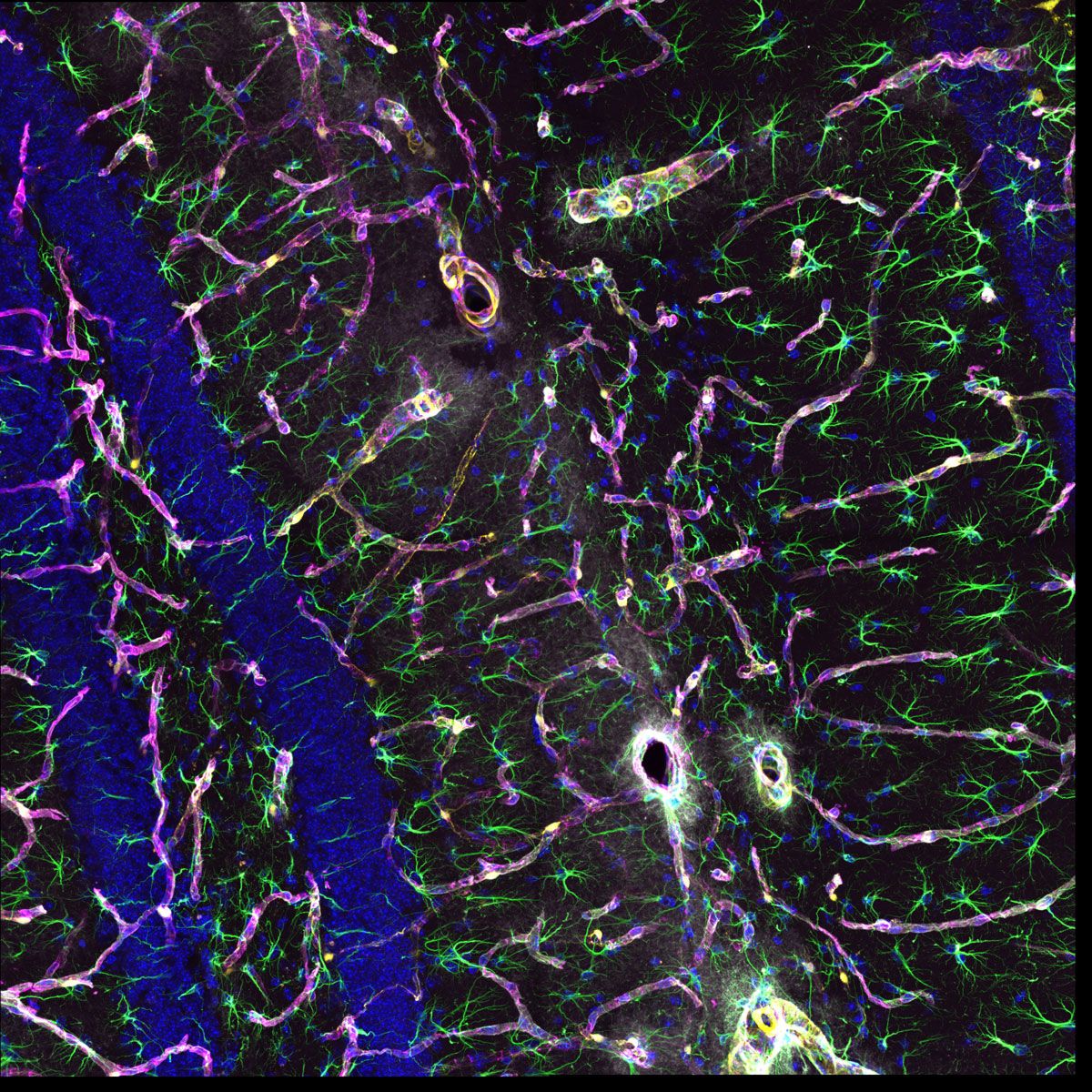
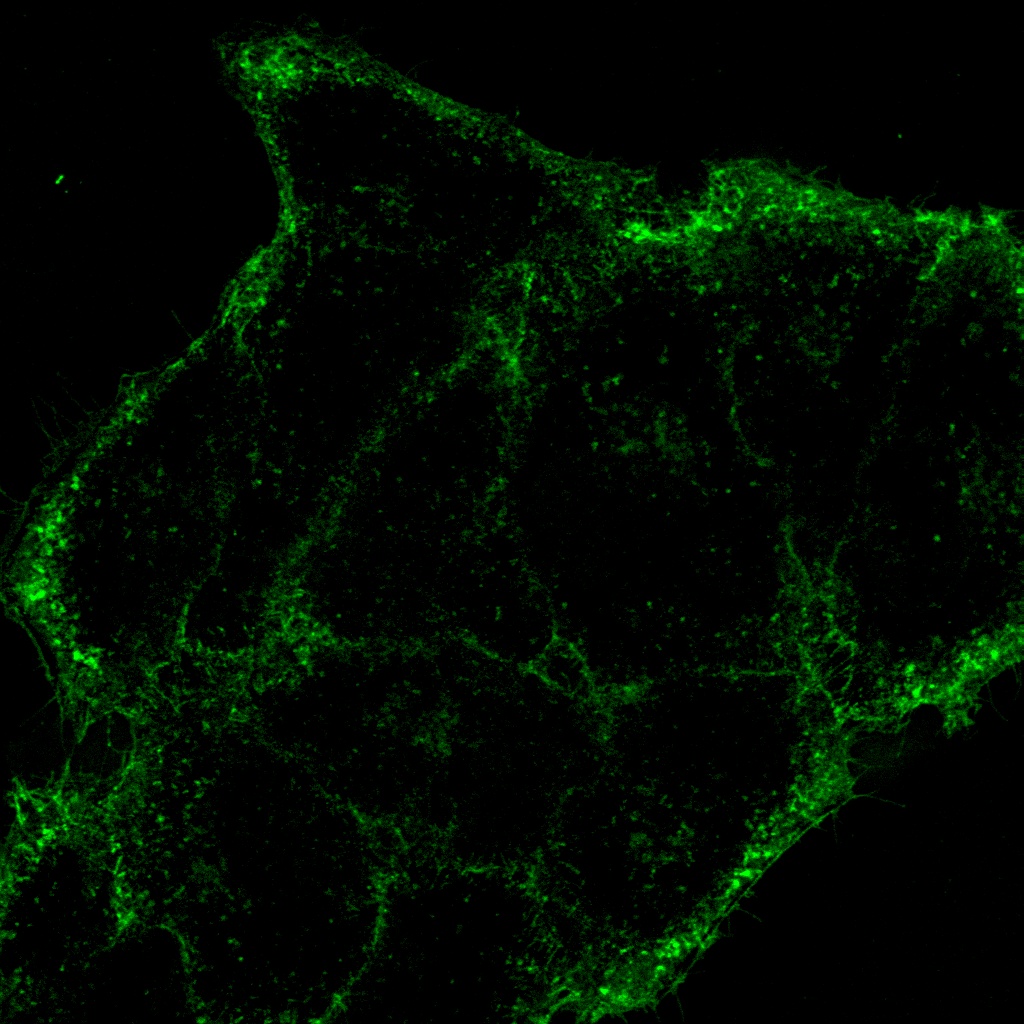
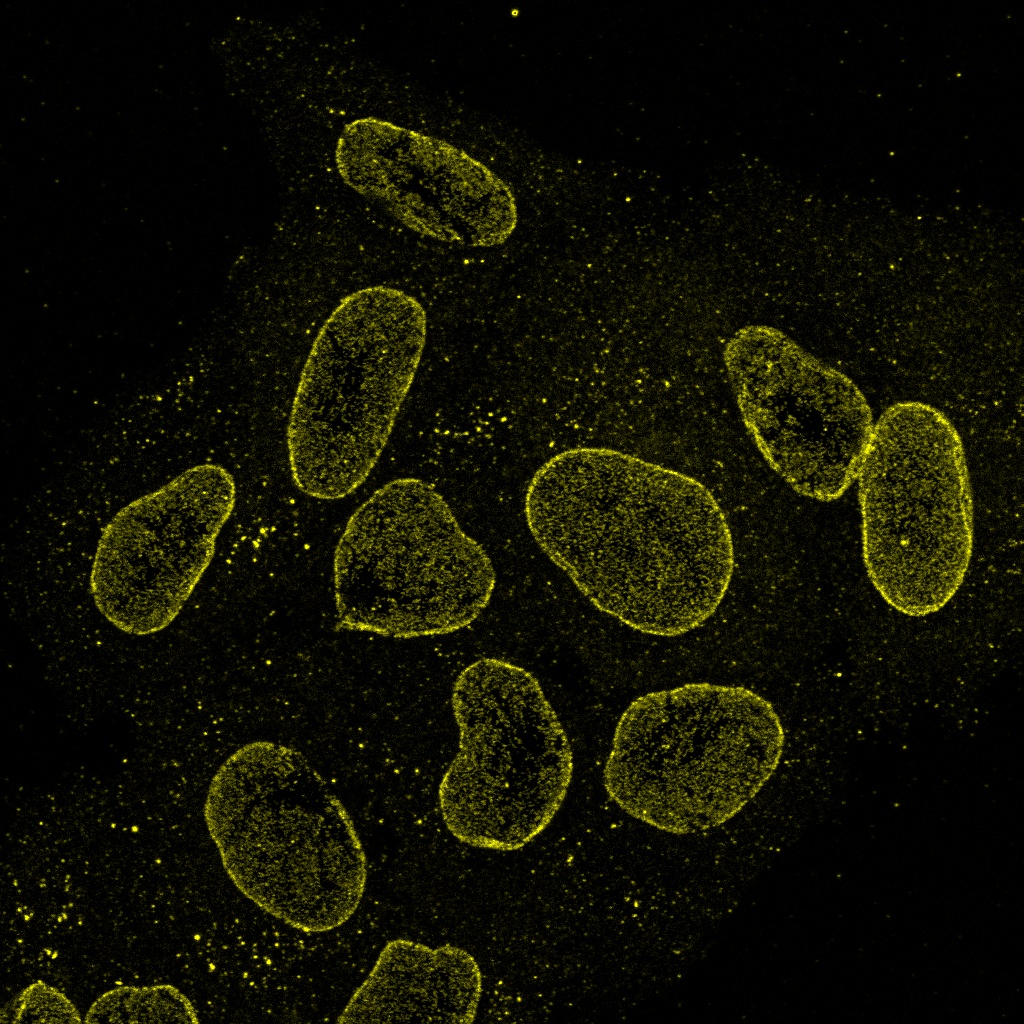
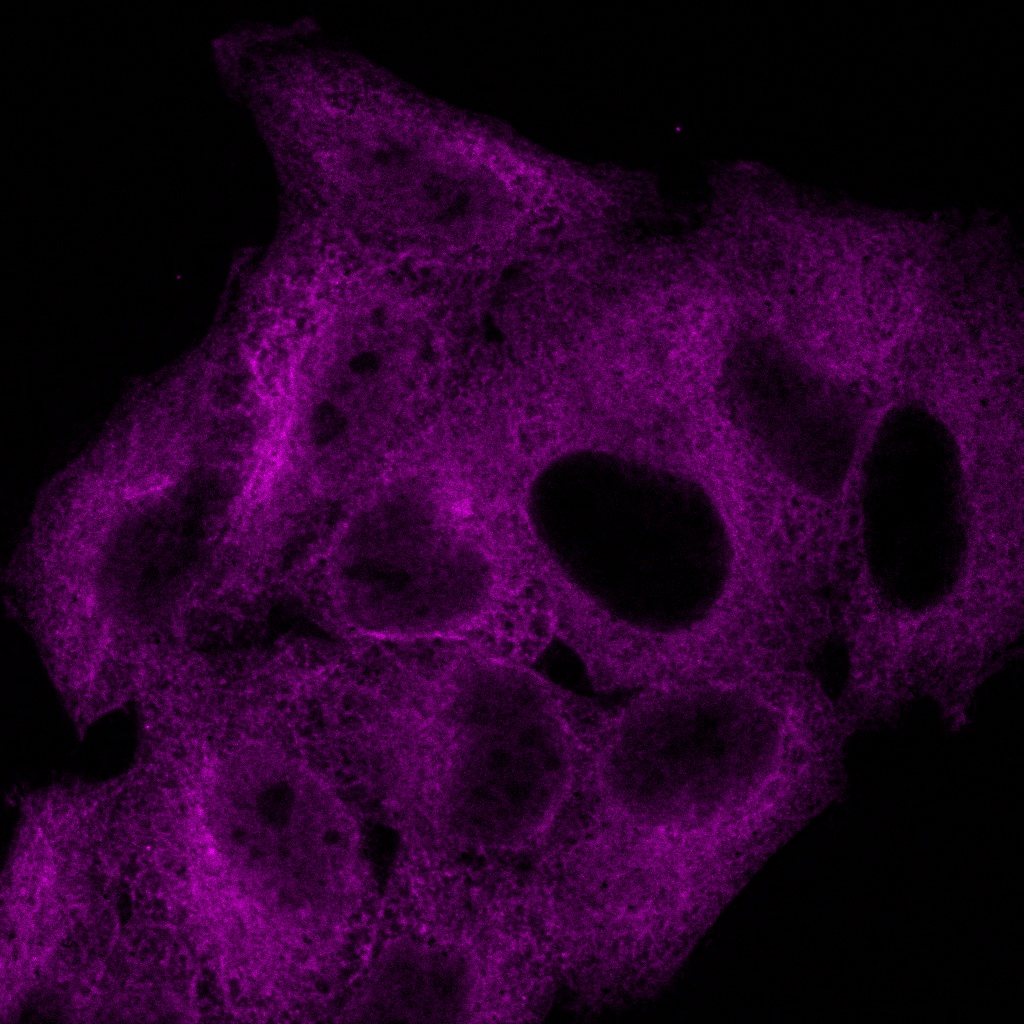
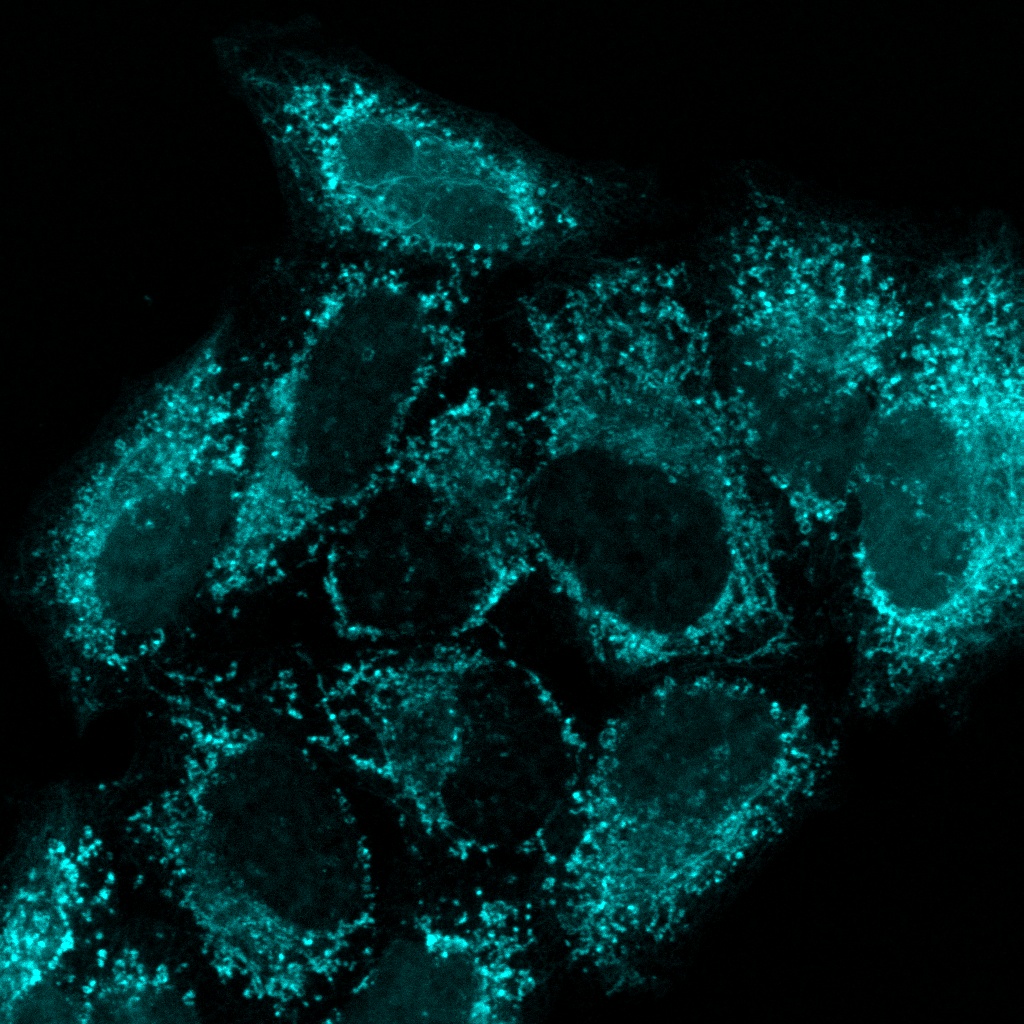
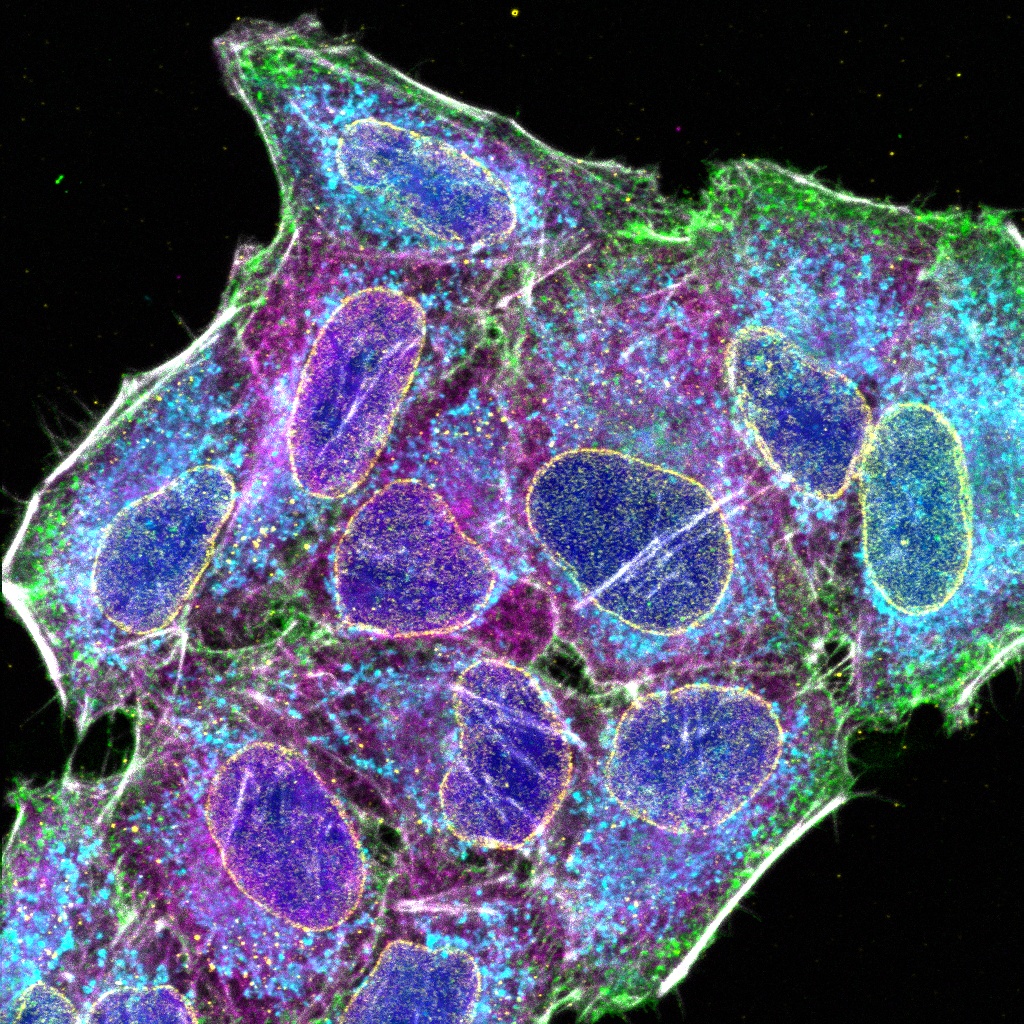
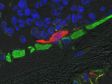
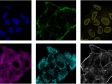
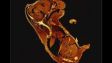
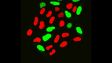
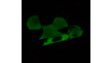
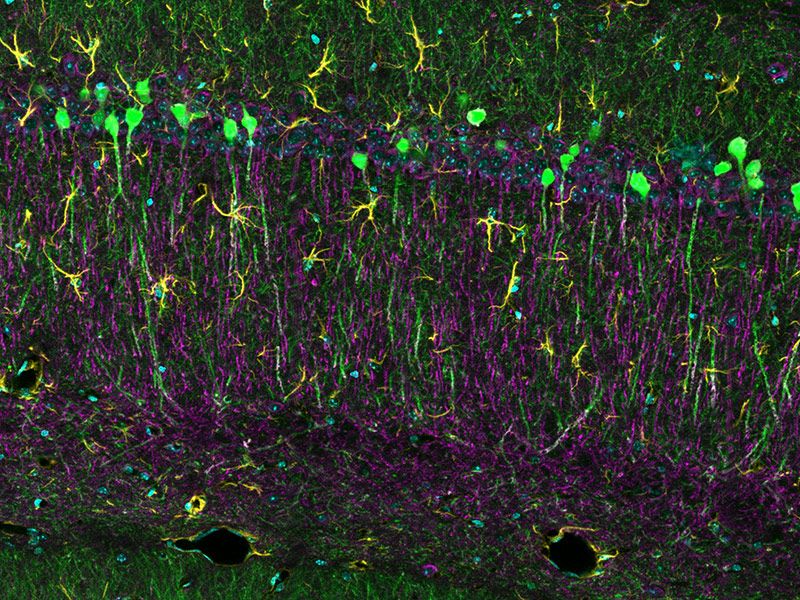
 Verarbeitet mit TruAI Rauschunterdrückung (rechts) Gehirnprobe: koronaler Schnitt (50 μm) eines Maushirns, gefärbt mit DAPI (Kerne, cyan), GFAP (Astrozyten, grün/488), MAP2 (Mikrotubuli-assoziiertes Protein 2, Neuronen und dendritische Fortsätze, cyan/647) und MBP (Myelin-basisches Protein, rot/568). Bildquelle: Probenaufbereitung: Alexia Ferrand; Probenaufnahme Sara R. Roig und Alexia Ferrand. Imaging Core Facility, Biozentrum, Universität Basel. |  Verarbeitet mit TruAI Rauschunterdrückung (rechts) MitoView 720-markierte Mitochondrien von HeLa-Zellen, aufgenommen mit einem 1K Resonanzscanner. Die maximale Photonenzahl betrug 3 Photonen. |
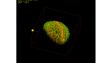
Schnellere und einfachere BildanalyseDie Bildanalyse erfordert die Datenextraktion mithilfe von Segmentierungstechniken basierend auf Intensitätsgrenzwerten. Dies kann jedoch zeitaufwändig sein und ist von den Probenbedingungen abhängig. Die TruAI Bildsegmentierung mit Deep Learning kann die Bildverarbeitung effizienter machen und Probenvariablen für eine genauere Bildanalyse minimieren. Mit der TruAI Bildsegmentierung können auch Fluoreszenzbilder mit sehr schwachem Signal oder Gewebeproben, die mithilfe der einfachen Schwellenwertmethode normalerweise schwer zu extrahieren sind, leistungsstark segmentiert werden. |  TruAI erkennt die Glomeruli-Merkmale (rechts) |
Benötigen Sie weitere Informationen? |
Konfigurationen
Das FV4000 Mikroskop ist ein modular aufgebautes System, das ganz einfach je nach Anwendung und Budget konfiguriert werden kann. Falls notwendig, kann das FV4000 Standardmodell zum Beispiel problemlos auf Multiphotonen-Bildgebung umgerüstet werden, indem das MPE-Modul hinzugefügt wird.
| ||||||||
Für Unterstützung |
Technische Angaben
| Scanner |
Galvanometer-Scanner
(normale Bildgebung) | 64 × 64 bis 4096 × 4096 Pixel, 1 μs/Pixel bis 1000 μs/Pixel | |
|---|---|---|---|
|
Resonanzscanner
(Hochgeschwindigkeitsbildgebung) | 512 × 512 Pixel, 1024 × 1024 Pixel | ||
| Sehfeldzahl | 20 | ||
| Spektraler konfokaler Detektor | Detektor | SilVIR Detektor (gekühltes SiPM, Breitbandtyp/rotverschobener Typ) | |
| Maximale Kanäle | Sechs Kanäle | ||
| Spektralverfahren | VPH, erfassbarer Wellenlängenbereich 400–900 nm | ||
| Laser | VIS-Laser | 405 nm, 445 nm, 488 nm, 514 nm, 561 nm, 594 nm, 640 nm | |
| NIR-Laser | 685 nm, 730 nm, 785 nm | ||
| Laserleistungsmonitor | Eingebaut | ||
| Bild | Photonenzählung mit HDR (1G cps, 16 Bit) | ||