Von Robert Hookes erster Beobachtung gekammerter „Zellen“ unter seinem selbstgebauten Mikroskop über Osamu Shimomuras Erforschung von Quallen-Aequorin und GFP bis zu Xiaowei Zhuangs neuartigen blinkenden Farbstoffmolekülen bei der superauflösenden 3D-Rekonstruktion – die Erforschung der Mikrokosmen des Lebens entwickelte sich dank der optischen Mikroskopie immer weiter.
Als tragende Säule der vierten industriellen Revolution erlebte die Nanotechnologie im 21. Jahrhundert eine Blütezeit, zunächst in den Materialwissenschaften. An der Schnittstelle zwischen Nanotechnologie und Biowissenschaften entstand eine neue Innovation – fluoreszierende Nanosonden, die den Mikrokosmos des Lebens durch Nanomaterialien zum Leuchten bringen.
Anfänge der Fluoreszenzmikroskopie
Fluoreszenz ist eine Form der Photolumineszenz und wird durch die Absorption von Licht erzeugt. In der Natur gibt es zahlreiche Fluoreszenzphänomene. Das aus Leuchtquallen gewonnene grün fluoreszierende Protein (GFP) war die erste praktische Anwendung dieses Phänomens zur Erforschung der lebenden mikroskopischen Welt. In den frühen 90er Jahren fand man heraus, dass der Einbau des GFP-Gens in andere lebende Organismen und dessen Expression dazu führten, dass Organismen, die von Natur aus keine Fluoreszenz erzeugen, grün fluoreszieren. Seitdem wurden die verfügbaren Farben, die Lichtintensität, die Stabilität und andere Eigenschaften durch Analyse der Struktur und Mechanismen von GFP weiter verbessert und so die Entwicklung und Anwendung von fluoreszierenden Proteinen (FPs) im Bioimaging erheblich vorangebracht (Abbildung 1).
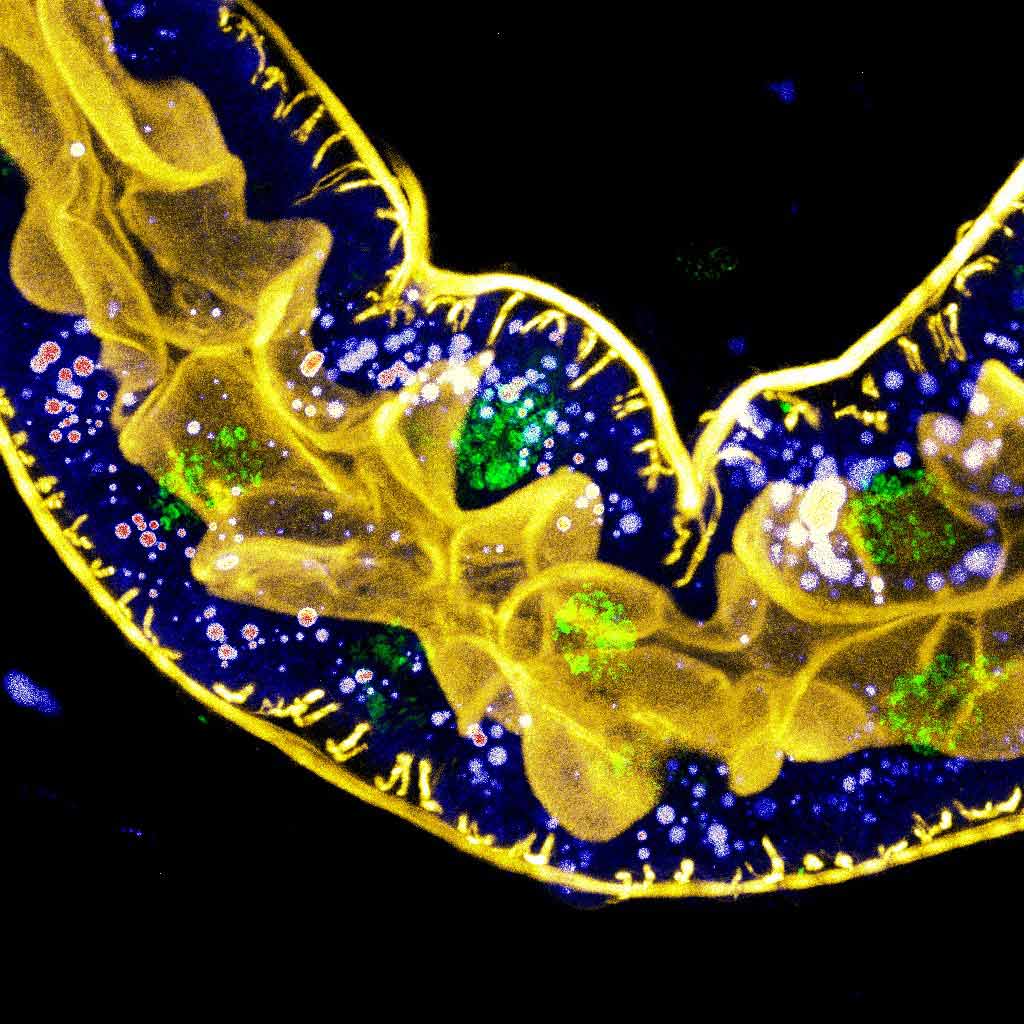
Abbildung 1. Mehrfarbige Fluoreszenzaufnahme des Hinterdarms einer Drosophila-Larve, in der das F-Actin gelb und die Zellkerne grün dargestellt und Lipidtropfen durch Farbzuweisung in einer intensitometrischen Lookup-Tabelle (LUT) markiert sind.
Obwohl die Familie der fluoreszierenden Proteine immer größer wird, ist ihr Anwendungsbereich immer noch begrenzt. Das Emissionsspektrum von fluoreszierenden Proteinen ist breit und asymmetrisch, was häufig zu gegenseitigen Störungen bei gleichzeitiger Mehrkanal-Bildgebung führt. Durch chemische Synthese entstanden organische Farbstoffe mit großer Vielfalt und einfacher Handhabung, die nicht nur den Anwendungsbereich der Fluoreszenzbildgebung erheblich erweiterten, sondern auch die kommerzielle Standardproduktion erleichterten und damit eine solide Grundlage für einen neuen Entwicklungssprung schufen.
Nanomaterialien bringen Fortschritte im Bioimaging
Nach und nach erwiesen sich bestimmte Nachteile organischer Farbstoffe, z. B. die geringe Fluoreszenzeffizienz und mangelnde Photostabilität, als Hemmnisse für die Weiterentwicklung der Fluoreszenzbildgebung. Nanomaterialien hingegen eröffnen aufgrund ihrer besonderen optischen Eigenschaften, der gerichteten Synthese und Assemblierung sowie anderer Vorteile neue Möglichkeiten. Derzeit gängige fluoreszierende Nanomaterialien (Abbildung 2):
- Halbleiter-Quantenpunkte (Quantum Dots, QDs)
- Seltene Erden-Rohstoffe für die Aufwärtskonvertierung (Upconversion Nanoparticles, UCNPs)
- Edelmetall-Nanopartikel
Im Vergleich zu anderen Farbstoffen haben fluoreszierende Nanomaterialien Vorteile wie hohe Quantenausbeute, hohe Stabilität, große Stokes-Verschiebung, ein breites Anregungs- und ein enges Emissionsspektrum. Die Emissionswellenlängen können durch Anpassung der Größe verändert werden. Durch Assemblierung und Modifikationen lassen sich ihre Biokompatibilität sowie ihre Erkennungs- und Sensorfunktionen verbessern. Alles in allem bieten Nanomaterialien hervorragende Möglichkeiten für die Fluoreszenzmarkierung und künftige Anwendungsgebiete der Fluoreszenzbildgebung.
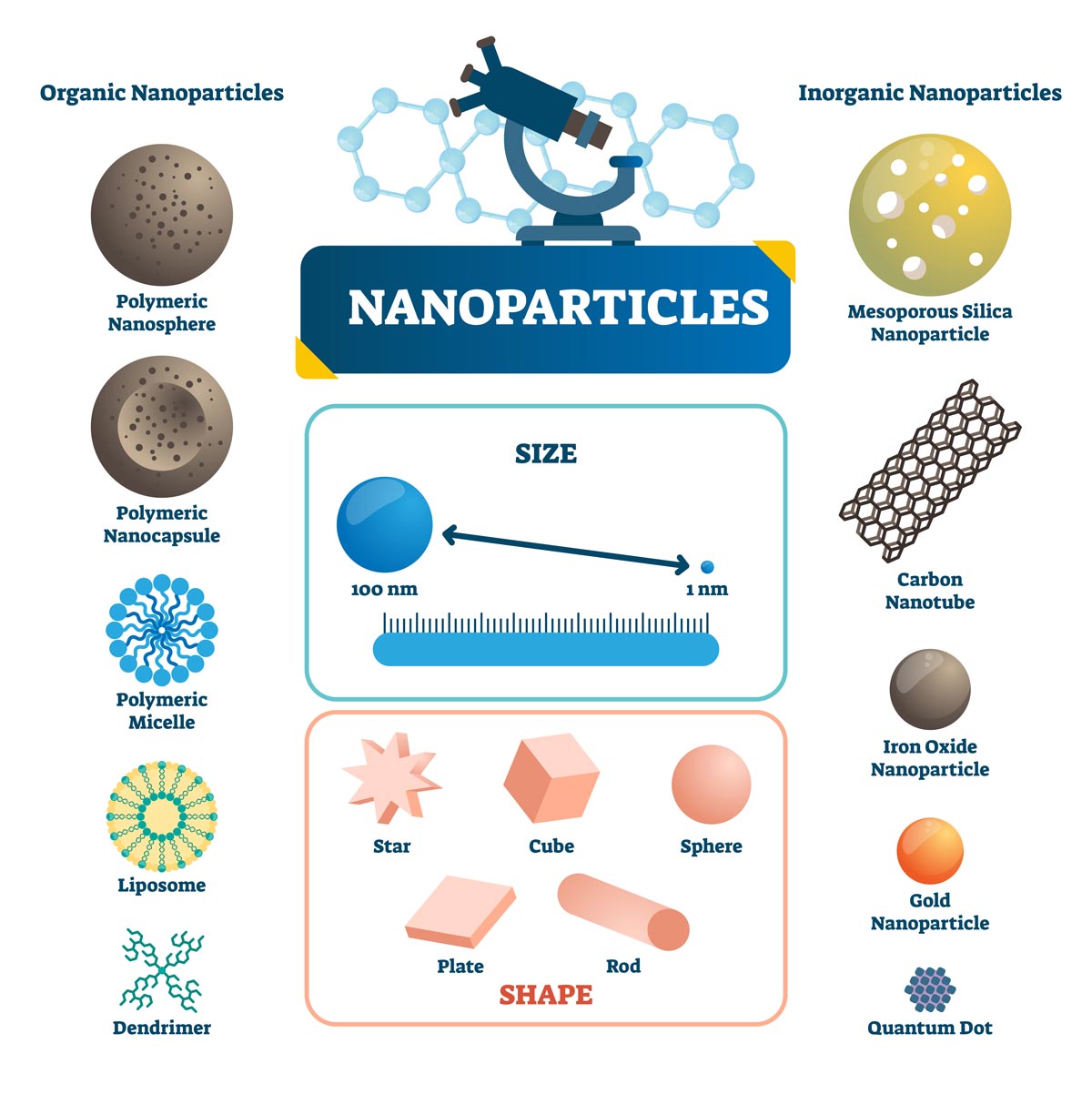
Abbildung 2. Beispiele organischer und anorganischer Nanopartikel mit Größe, Form und Materialien
Grundlegender Arbeitsablauf bei fluoreszierenden Nanosonden
Da es sich um einen interdisziplinären Prozess unter Einbeziehung von Nanochemie und Bioimaging handelt, unterscheidet sich der Arbeitsablauf bei der Herstellung fluoreszierender Nanosonden von dem beim herkömmlichen Bioimaging. Es ist ein mehrstufiger Prozess, der theoretische Berechnungen, chemische Synthese, Bioimaging und selbst medizinische Tests umfasst (Abbildung 3).
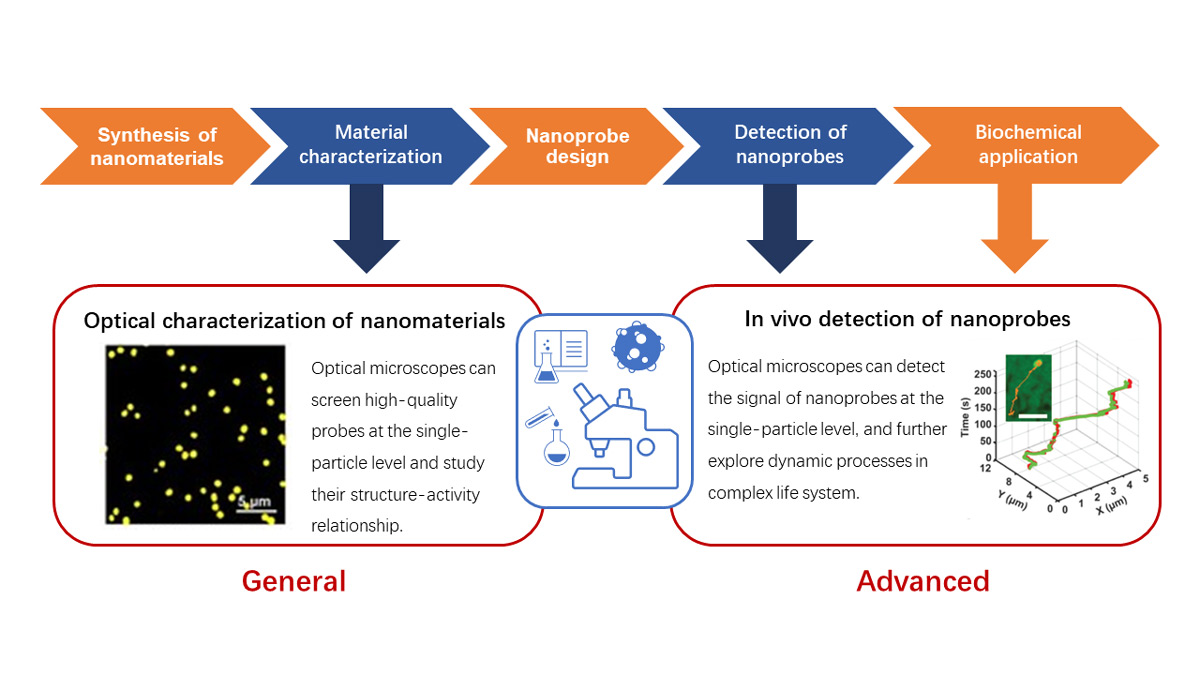
Abbildung 3: Grundlegender Arbeitsablauf bei fluoreszierenden Nanosonden
Die Forschungsprozesse mit fluoreszierenden Nanosonden sind meist anwendungsorientiert. Fluoreszierende Nanosonden werden beim Bioimaging sowohl für In-vitro-Proben als auch für die dynamische In-vivo-Bildgebung und selbst in der medizinischen Diagnostik und in medizinischen Studien eingesetzt. Aus diesem Grund spielt bei der Entwicklung der Nanosonde die biologische Anwendung eine wichtige Rolle. Nanomaterialien mit besonderen optischen Eigenschaften oder anderen Funktionen (z. B. für nahes Infrarot, Aufwärtskonvertierung, Zwei-Photonen-Mikroskopie usw.) werden entsprechend den konkreten Anforderungen der biologischen Anwendungen ausgewählt und anschließend synthetisiert und hinsichtlich ihrer Qualität charakterisiert. Anschließend werden die Sonden weiter angepasst und unter Berücksichtigung ihrer Biokompatibilität bzw. der Anforderungen an ihre Funktion, wie zum Beispiel optische Manipulation, Beladung mit Arzneistoffen, molekulare Erkennung usw., zusammengesetzt (Abbildung 4).
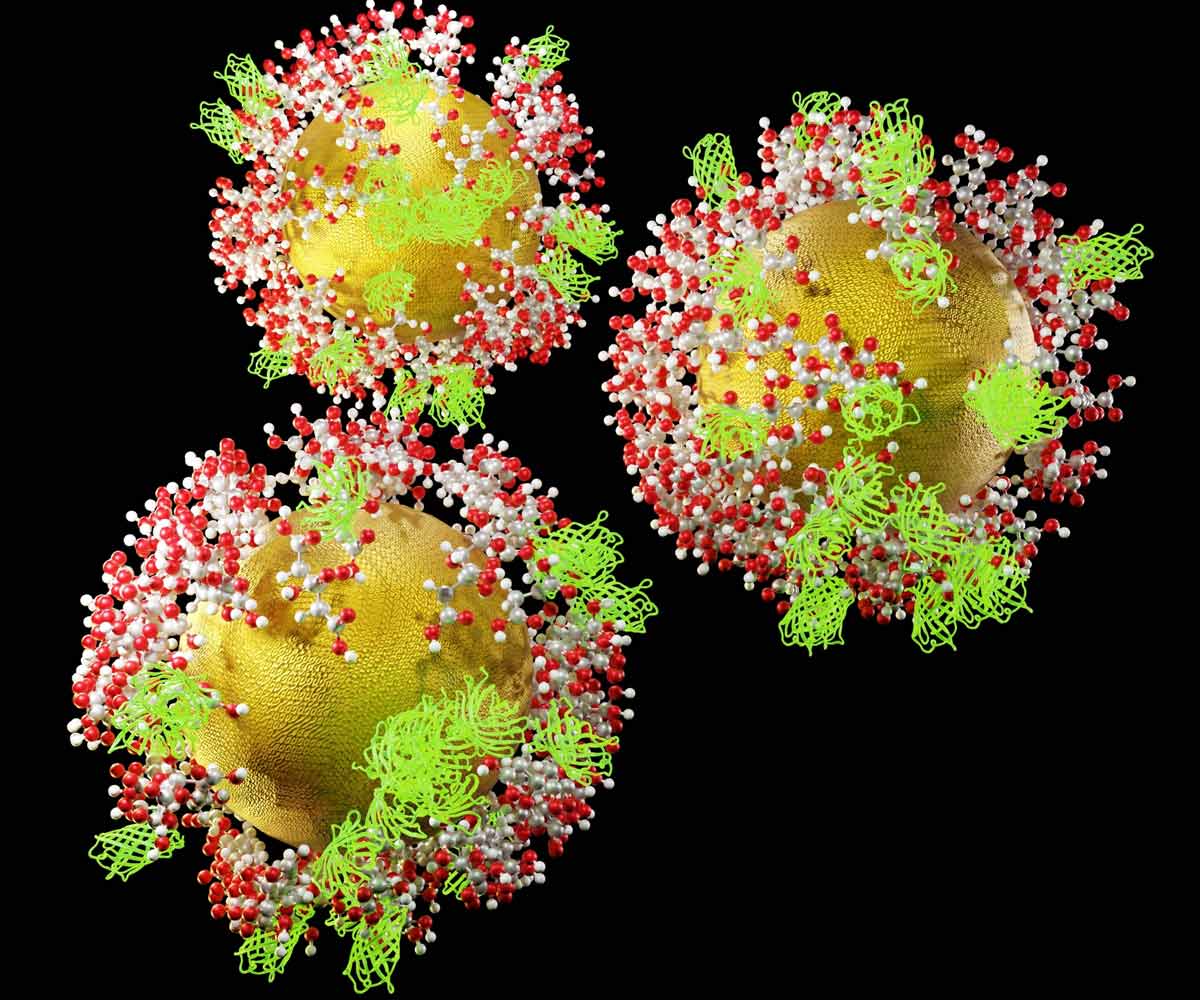
Abbildung 4: 3D-Darstellung von funktionalisierten Gold-Nanosonden (GNPs), beschichtet mit grün fluoreszierenden Proteinen (GFP) und Zitronensäuremolekülen
In der Forschung mit fluoreszierenden Nanosonden wird die optische Mikroskopie hauptsächlich in drei Bereichen eingesetzt: Zur Charakterisierung, zum Screening von hochwertigen Nanomaterialien und zur In-vivo-Detektion von Nanosonden. Beim Screening sind die Eigenschaften verschiedener Partikel aufgrund ihrer inhärenten strukturellen Heterogenität oft sehr unterschiedlich. Im Gegensatz zu herkömmlichen Methoden, bei denen es eher um die Summe der Eigenschaften einer
großen Partikelanzahl geht, ermöglicht die optische Mikroskopie das Screening hochwertiger Sonden auf der Ebene des einzelnen Partikels und die weitere Untersuchung der Zusammenhänge zwischen Struktur und Funktion im Hinblick auf das Design und die Synthese dieser Sonden. Beim Bioimaging ermöglicht die optische Mikroskopie die Erfassung optischer Signale von Nanosonden in vivo, um dynamische räumliche und zeitliche Reaktionen abzubilden und zu verfolgen.
Anwendungen fluoreszierender Nanosonden und Mikroskopielösungen in der Forschung
Nahinfrarot-Bildgebung/ Aufwärtskonvertierung mit einer konfokalen Mikroskoplösung
Die Bildgebung im nahen Infrarotspektrum ist derzeit ein Forschungsschwerpunkt in der optischen Mikroskopie, da Licht dieser Wellenlängen tief in das Gewebe eindringen kann, die Phototoxizität niedrig ist und wenig Interferenz durch Gewebeautofluoreszenz vorliegt. Fluoreszierende Nanosonden, z. B. Quantenpunkte, können durch Anpassung ihrer chemischen Zusammensetzung, Morphologie und Größe leicht eine NIR-Anregung erreichen. Darüber hinaus haben aufwärtskonvertierende Nanomaterialien eine besondere optische Eigenschaft, die gerade für die NIR-Bildgebung interessant ist: Sie emittieren Licht mit einer kürzeren Wellenlänge (sichtbares oder UV-Licht) als das Anregungslicht, wenn sie mit langwelligem Licht (im NIR-Spektrum) angeregt werden. Aufgrund dieser Vorteile gelten aufwärtskonvertierende Nanosonden als fluoreszierende Biomarker einer neuen Generation und dürften eine wichtige Rolle in der Biomedizin, der Energie- und Katalyseforschung und anderen Bereichen spielen.
Der empfindliche In-vivo-Echtzeitnachweis von Hepatotoxizität ist derzeit ein Engpass bei der Diagnose von arzneimittelinduzierten Leberschäden. In einer im Jahr 2020 veröffentlichten Arbeit der Forschungsgruppe von Professor Li Huijun wurde eine aufwärtskonvertierende Nanosonde entwickelt, die aus aufwärtskonvertierenden Nanopartikeln (UCNPs) und Goldnanostäbchen (GNR) besteht und zur Echtzeit-Diagnose von arzneimittelbedingten Leberschäden in situ eingesetzt wird. Diese neuartige Nanosonde kann sich in die Leber einlagern und durch einen Marker für Leberschäden, miR122, spezifisch aktiviert werden. Sie erzeugt Fluoreszenzbilder bei 800 nm, wenn sie durch Licht im nahen Infrarotspektrum bei 980 nm angeregt wird. Durch Kombination mit Lumineszenz-Resonanz-Energie-Transfer (LRET) und einer Signalverstärkungstechnologie wird die Erkennungsempfindlichkeit weiter erhöht, sodass eine hochempfindliche Detektion von miR122 erreicht wird. Damit ergibt sich ein neuer Ansatz für die klinische Echtzeit-Überwachung von arzneimittelinduzierten Leberschäden. [4]
Anders als bei der konventionellen konfokalen Bildgebung erfordert die Bildgebung von NIR-/aufwärtskonvertierenden Nanosonden Geräte mit spezifischen Eigenschaften:
- In der konventionellen konfokalen Mikroskopie werden üblicherweise Anregungswellenlängen von 400–650 nm verwendet, während für die Bildgebung im nahen Infrarotspektrum NIR-Laser mit Wellenlängen > 700 nm erforderlich sind.
- Die meisten Komponenten im optischen Strahlenweg für die konventionelle Bildgebung, z. B. Scanning-Galvanometer, Objektive und Beugungsgitter, unterstützen nur die Entspiegelung/Kalibrierung im sichtbaren Spektrum und erreichen nicht die Effizienz und Genauigkeit der NIR-Bildgebung.
- Eine NIR-Detektion erfordert spezielle > 750 nm NIR-Detektoren
Die Technologie des konfokalen Lasermikroskops FLUOVIEW FV4000 für die NIR-Bildgebung wird diesen Anforderungen gerecht (Abbildung 5). Das System FV4000 ist für die hochempfindliche und genaue NIR-Bildgebung mit mehreren Farben besonders gut geeignet.
|  |
Abbildung 5: Das modulare konfokale Laserscanning-System FLUOVIEW FV4000 ist ideal für die NIR-Bildgebung |
In diesem Anwendungshinweis, der in Zusammenarbeit mit Dr. Kai Li (Southern University of Science and Technology, China) entstand, wird über den erfolgreichen Einsatz der FLUOVIEW NIR-Lösung zur Bestimmung der Targetgenauigkeit des NIR-Fluoreszenzmoleküls mit BTB-basierten Nanopartikeln auf Tumorzellen berichtet. (Abb. 6) In dieser Studie modifizierten die Forschenden die Oberfläche der BTB-Nanosonde mit dem Arg-Gly-Asp(RGD)-Targetingpeptid und beobachteten bei Mäusen, denen BTB-RGD-NPs injiziert wurden, innerhalb von 6 Stunden eine signifikante Zunahme des NIR-II-Fluoreszenzsignals an der Tumorstelle im Vergleich zu der BTB-Nanosonde.
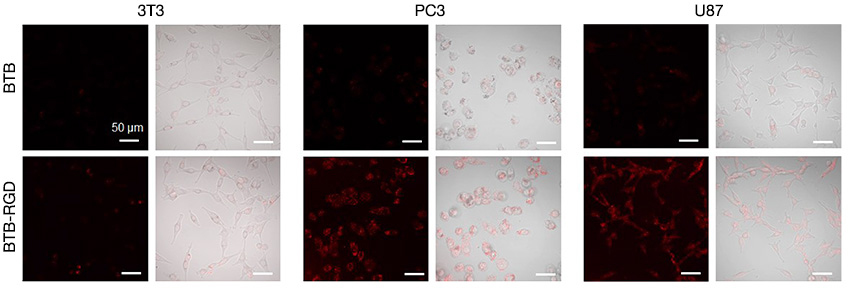
Abbildung 6: Konfokale Bilder von 3T3-, PC3- und U87-Zellen mit FV3000 Red nach Inkubation mit 40 μg pro ml BTB-RGD bzw. BTB-NPs über 4 Stunden.
Anregungswellenlänge: 730 nm, Filter: 760–890 nm, Maßstabsleiste = 50 μm.
In-vivo-Aufnahme von Tumormarkern mit dem FLUOVIEW Multiphotonenmikroskop und der Deep-Detection-Lösung
Krebserkrankungen zählen zu den gravierendsten Gesundheitsproblemen. Die aktuelle medizinische Forschung zielt in erster Linie auf die frühzeitige Diagnose und präzise Entfernung bösartiger Tumore ab. Die Entwicklung neuartiger fluoreszierender Nanosonden zur spezifischen Identifizierung von Tumormarkern und für die hochauflösende In-vivo-Bildgebung ermöglicht neue Nachweismethoden zur klinischen Frühdiagnose bösartiger Tumore und deren präziser chirurgischen Entfernung.
Die Überexpression von Enzymen wie der alkalischen Phosphatase (ALP) in Tumorzellen ist ein wichtiger klinischer Indikator für das Auftreten, die Entwicklung und das Fortschreiten von Tumoren. Daher kann eine schnelle Nachweismethode mit hoher Empfindlichkeit für die ALP-Aktivität bei der Früherkennung und genauen Entfernung von Tumoren helfen. Im Jahr 2020 veröffentlichten Professor Xiaojun Peng und sein Team eine Arbeit über den Einsatz einer Nanosonde, die genau für diesen Zweck entwickelt wurde. In der Arbeit werden die Entwicklung und Herstellung einer AIEgen-Sonde (DQM-ALP) beschrieben, die nach Interaktion mit überexprimierter ALP in Tumorzellen bei der Aggregation ein starkes Fluoreszenzsignal abgibt. Bei dieser Nanosonde wurde das Problem der Fluoreszenzabschwächung, das bei herkömmlichen organischen Farbstoffen durch Aggregation entsteht, eliminiert, was die Detektionsempfindlichkeit und Verweildauer der Sonde in Tumorzellen erhöht. Im Rahmen dieser Arbeit wurde erstmals die Hochregulierung der ALP-Aktivität in Tumorzellen durch Natriumbutyrat und Cortisolstimulation entdeckt. Zudem gelang mithilfe der Zwei-Photonen-Mikroskopie die dreidimensionale Tiefendarstellung der ALP-Aktivität in HeLa- und HepG-2-Tumor-Sphäroiden mit hoher räumlicher Auflösung. Der Artikel zeigt die Eignung der Sonde zur Fluoreszenzdetektion von Tumoren im Submillimeterbereich als leistungsfähiges Hilfsmittel für die klinische Diagnose und die chirurgische Entfernung von Tumoren auf. [5]
In der oben genannten Studie wurden konfokale Ein- und Zwei-Photonen-Mikroskope verwendet. Das neueste FLUOVIEW Multiphotonenmikroskop für die Fluoreszenzbildgebung tiefer Schichten in vivo mit einem proprietären Hochgeschwindigkeits-Resonanz-Scanning-Galvanometer und einem hochempfindlichen optischen Detektionspfad ermöglicht hingegen eine genauere und effizientere hochauflösende 3D-Tiefenbildgebung von Tumormarkern (Abbildung 7).
Die Kombination von Dual-Line/Dual-Lasern und hochempfindlicher Detektion auf bis zu sechs Kanälen im Multiphotonen-System von Evident unterstützt eine flexiblere Mehrfarben-Bildgebung und erhöht den Detektionsdurchsatz und die Effizienz weiter.
Multiphotonen-System FV4000MPE
|  |
Abbildung 7: Multiphotonensystem FV4000MPE mit Modulen für die Tiefenbildgebung |
Dynamische Detektion von Nanosonden in lebenden Zellen mit IXplore SpinSR Rapid Super Resolution
Biochemische Reaktionen und andere molekulare Ereignisse in lebenden Zellen weisen oft eine erhebliche räumliche und zeitliche Dynamik auf. Die optische Bildgebungstechnologie macht es möglich, die Bewegung von Nanosonden genau zu verfolgen und ihre Wechselwirkungen mit Biomolekülen zu untersuchen. Damit können diese Biomarker effektiv überwacht und dynamische Veränderungen nachverfolgt werden, um die Zusammenhänge zwischen deren Zuständen und relevanten Zellfunktionen weiter zu erforschen. Endosomen, Lysosomen und andere Organellen spielen eine Schlüsselrolle bei der Signalübertragung und der Aufrechterhaltung der Stoffwechselhomöostase. Die schnelle und empfindliche Bestimmung des pH-Werts in diesen Organellen, der bei der Endozytose Änderungen unterworfen ist, steht im Mittelpunkt der Forschung zur dynamischen Überwachung des Endozytoseprozesses und zu den Beziehungen zwischen deren Zuständen und den Zellfunktionen.
Im Jahr 2016 stellte das Forschungsteam von Professor Yiguang Wang der Universität Peking und Professor Jinming Gao des Southwestern Medical Center der University of Texas eine ultraempfindliche pH-Nanosonde (HyUPS) mit Einzelorganellen-Auflösung vor. Mit dieser Nanosonde konnten sie pH-Änderungen in Endosomen/Lysosomen und anderen Organellen während der Endozytose verfolgen und erkennen. Die Sonde enthält drei pH-empfindliche Komponenten, die den drei Komponenten der Endozytose und drei pH-Bereichen entsprechen und mit roten, grünen bzw. blauen Fluorophoren markiert sind. Damitermöglichte die Sonde erfolgreich die dynamische Echtzeit- und Mehrfarbenüberwachung der Azidifizierungsrate in Organellen, die an der Endozytose in lebenden Zellen beteiligt sind, und stellt damit ein neues Bildgebungsinstrument für weitere Studien über Erkrankungen infolge einer endosomalen/lysosomalen Dysfunktion dar. [6]
Die Bildgebung von Nanosonden in einer lebenden Probe erfordert Hochgeschwindigkeits-Bildgebungsgeräte, da die herkömmliche konfokale Punktabtastung den Anforderungen nicht gerecht wird. Das konfokale IXplore SpinSR Bildgebungssystem mit Spinning-Disk und Superauflösung kann schnelle (200 fps) Mehrfarbenbilder in Superauflösungsqualität (110 nm) darstellen (Abbildung 8). Dadurch wird es möglich, die schnellen dynamischen Prozesse feiner Strukturen zu erfassen, was das System als leistungsstarkes Werkzeug zur Verbesserung der Bildgebungseffizienz in den Biowissenschaften auszeichnet. Der proprietäre RTCe (Echtzeit-Controller) steuert den synchronisierten Betrieb aller Komponenten, um die Auswirkungen des Anregungslichts auf die Proben zu minimieren. Dieser Vorteil ermöglicht in Kombination mit Silikonöl-Objektiven speziell für die Tiefenbiopsie eine langfristig präzise Tiefenbildgebung von lebenden Zellen, Sphäroiden und organoiden Proben.
Ein Beispiel für die hochauflösende Bildgebung mit dem IXplore SpinSR System ist in Abbildung 9 dargestellt, die mit dem PKMDR-Farbstoff markierte Mitochondrien von Epithelzellen zeigt. PKMDR ist eine von Professor Zhixing Chen an der Universität Peking entwickelte mitochondriale Sonde, welche die Phototoxizität bei Fluoreszenz- und nanoskopischer Bildgebung minimiert.
Konfokales IXplore SpinSR System mit Spinning Disk
| |
Abbildung 8: Konfokales IXplore SpinSR Bildgebungssystem mit Spinning Disk und Superauflösung |
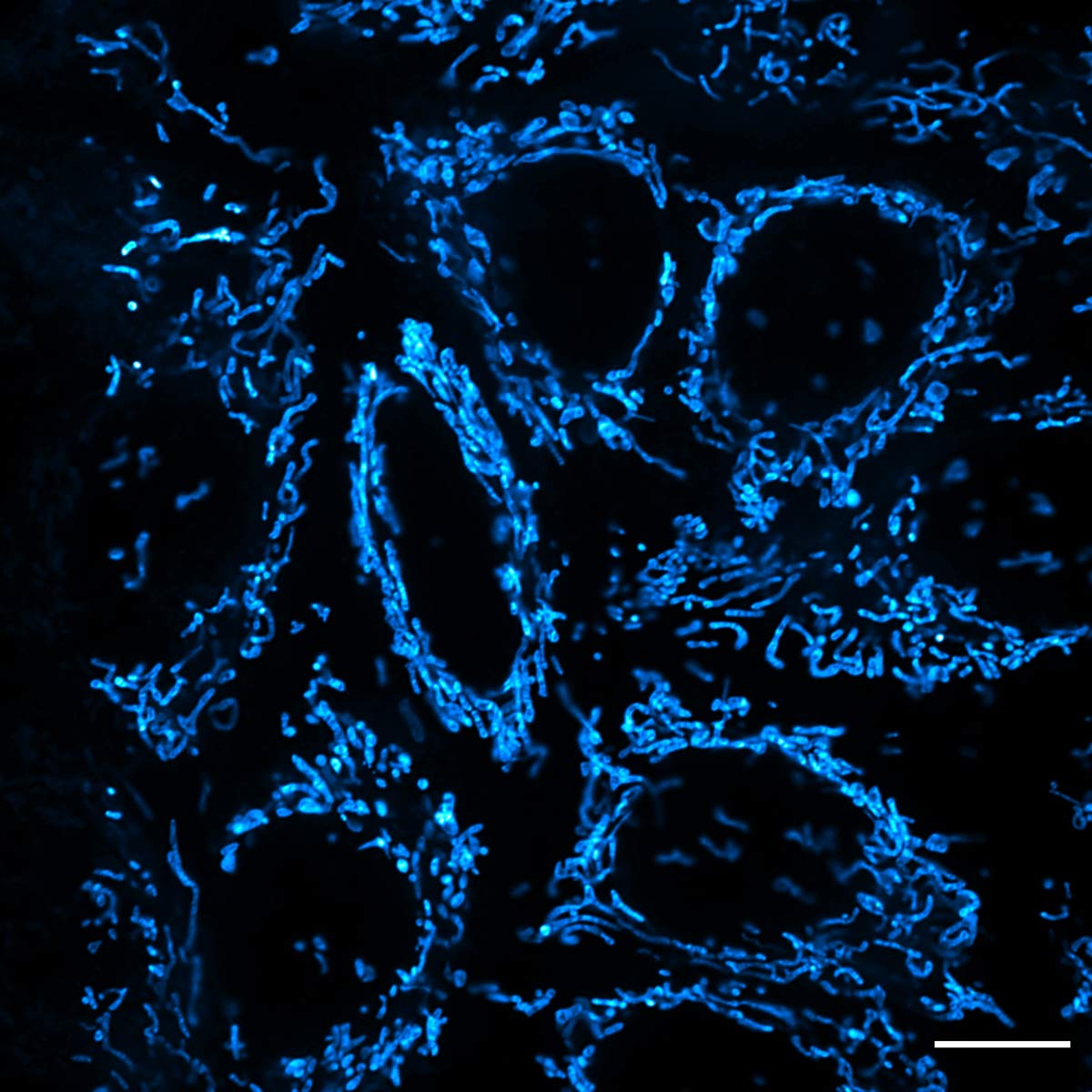
Abbildung 9: Hochauflösendes Bild von Epithelzellmitochondrien, markiert mit PKMDR-Farbstoff unter Verwendung des IXplore SpinSR Systems, des Objektivs UPLAPO60XOHR und TruSight Verarbeitung. Bildquelle: Dr. Huiwen Hao, Dr. Junsheng Yang, Prof. Yujie Sun und Prof. Zhixing Chen. Standard Imaging Co., Ltd. und Sun Lab, College of Future Technology, PKU. NanJing GenVivo Biotech Co., Ltd.
In den letzten zehn Jahren wurden dank der rasanten Entwicklung der Nanotechnologie und der Technologien für die optische Bildgebung viele wichtige Fortschritte in biochemischen Bildgebungsanwendungen unter Verwendung fluoreszierender Nanosonden erzielt Die Anwendung fluoreszierender Nanosonden ist jedoch noch immer durch ihre begrenzte Biokompatibilität, auftretendes Fluoreszenzblinken und andere Unzulänglichkeiten eingeschränkt. Mit der kontinuierlichen Entwicklung und Integration von Nanomaterialien und Bioimaging-Technologien, chemischer Synthese, theoretischer Physik und Bildanalyse dürften sich die Spezifität, Genauigkeit, Stabilität und Reproduzierbarkeit des Bioimagings mit fluoreszierenden Nanosonden künftig weiter verbessern, sodass diese Technologie eine zunehmend wichtige Rolle in diversen Forschungsbereichen spielen wird.
*Bei diesem Artikel handelt es sich um eine aktualisierte Fassung des am 6. Oktober 2022 veröffentlichten Originalinhalts.
Literaturnachweise:
[2]. Chang, H., Xie, J., Zhao, B., Liu, B., Xu, S., Ren, N., Xie, X., Huang, L., & Huang, W. (2014). Rare Earth Ion-Doped Upconversion Nanocrystals: Synthesis and Surface Modification. Nanomaterials (Basel, Schweiz), 5(1), 1–25.
[3]. Chen, Z., Wu, X., Hu, S., Hu, P., & Liu, Y. Multicolor upconversion NaLuF4 fluorescent nanoprobe for plant cell imaging and detection of sodium fluorescein. J. Mater. Chem. C, 2015, 3, 153-161
Ähnliche Artikel
Enhanced Darkfield Illumination: Label-Free Imaging at the Nanoscale
On the Road to a Breakthrough—Trailblazing Bioimaging Is Transforming Cancer Research

.jpg?rev=1A74)