Dr. Stephanie Shiers ist Wissenschaftlerin an der University of Texas in Dallas, an der sie 2019 ihren Doktortitel in Kognitions- und Neurowissenschaften erhielt. In ihren translationalen Studien untersucht sie die präklinischen Mechanismen und Therapien für chronische Schmerzen anhand von Spendergewebe menschlicher Nerven, das sie von der Southwest Transplant Alliance erhält.
Ihre Mikroskopbilder wurden in mehreren Fachzeitschriften veröffentlicht, zuletzt auf der Titelseite von Science Translational Medicine (16. Februar 2022). Wir haben Dr. Shiers gefragt, wie ein Bild sein muss, um es auf die Titelseite zu schaffen.

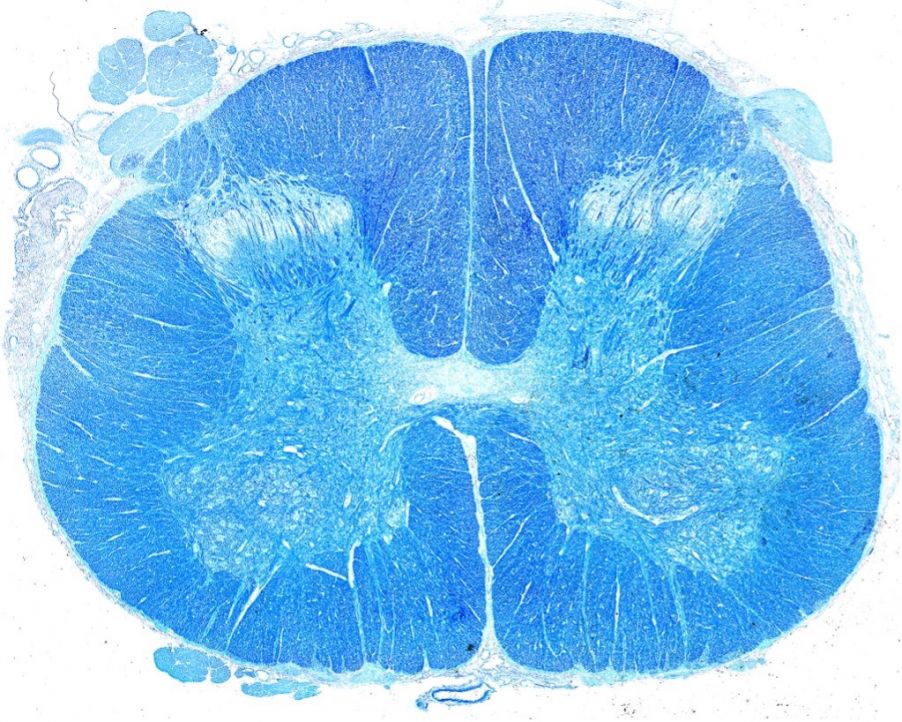
Dr. Stephanie Shiers’ Bild auf der Titelseite von Science Translational Medicine (Bd. 14, Ausgabe 632)(Nachdruck mit Genehmigung der AAAS).
F: Wer oder was hat sie dazu inspiriert, Wissenschaftlerin zu werden?
Dr. Shiers: Ich habe drei Hauptfächer und ein Nebenfach studiert, weil ich keine Ahnung hatte, was ich machen wollte. Ursprünglich wollte ich Medizin studieren. Nach einer Ausbildung zur Rettungssanitäterin wurde mir aber klar, dass ich doch nicht in Richtung Medizin gehen wollte. Dann entschied ich mich zusätzlich für Neurowissenschaften und Geschichte, weil ich dachte, dass mir Geisteswissenschaften besser liegen und ich Anwältin werde oder vielleicht eine Karriere in den Neurowissenschaften verfolge und dort promoviere. Am Ende meines Studiums wusste ich immer noch nicht, was ich beruflich machen wollte, bis ich in einem Labor auf dem Campus arbeitete. Das hat mir wirklich gefallen!
Schließlich bewarb ich mich für eine Stelle in der Immunhistochemie an der UC Davis/NIH NeuroMab Facility. In dieser Einrichtung wurden monoklonale Antikörper für die präklinische Forschung hergestellt. Ich habe jeden Teil dieser Arbeit geliebt. Ich fand es großartig, Proben einzufärben, Antikörper zu prüfen und mit dem Mikroskop zu arbeiten. Diese Arbeit hat mich erfüllt und mir die Augen geöffnet. Meine Mentoren Dr. Belvin Gong und Dr. Karl Murray haben mich sehr ermutigt und mir geholfen, mich für eine berufliche Laufbahn zu entscheiden. Während meiner Zeit im Labor habe ich erkannt, dass kaum etwas so viel Magie hat wie die Wissenschaft.’ Genau das vermittle ich jetzt immer unseren Studierenden und Doktoranden. Wir stellen Proteine und mRNAs her, die Fluoreszenz emittieren. Wir betrachten Dinge, die man mit bloßem Auge nicht sehen kann. Das führt dazu, dass wir oft etwas erfahren, das bis dahin noch niemand sonst auf dieser Welt weiß. Für mich ist das Magie.
F: Worauf sind Sie besonders stolz, und welchen Mikroskopie-Moment werden Sie niemals vergessen?
Dr. Shiers: Besonders stolz bin ich auf die Veröffentlichung meiner ersten wissenschaftlichen Abhandlung mit meinem Bild auf der Titelseite der Fachzeitschrift. Schon allein die Veröffentlichung meines ersten Artikels war aufregend. Ich hatte nicht damit gerechnet, auch auf die Titelseite zu kommen, da ich all die schönen Bilder nur aufgenommen hatte, weil ich die Neurowissenschaften liebe. Für die Bilder in meinem Artikel hatte ich ein Objektiv mit 40-facher Vergrößerung verwendet. Um noch schönere Bilder zu erhalten, wollte ich aber auch eine 100-fache Vergrößerung verwenden. Wir hatten gerade das Discovery Center mit einem neu installierten FV3000 Laser-Scanning-Konfokalmikroskop eröffnet, und ich hatte das System noch nie zuvor ausprobiert. Damit konnte ich alle Dendriten und das Initialsegment des Axons erkennen. Der Anblick war atemberaubend. Als ich diese Bilder meinem Forschungsleiter, Ted Price, zeigte, empfahl er mir, mich beim Einreichen meiner Arbeit mit diesen Bildern für das Cover zu bewerben.
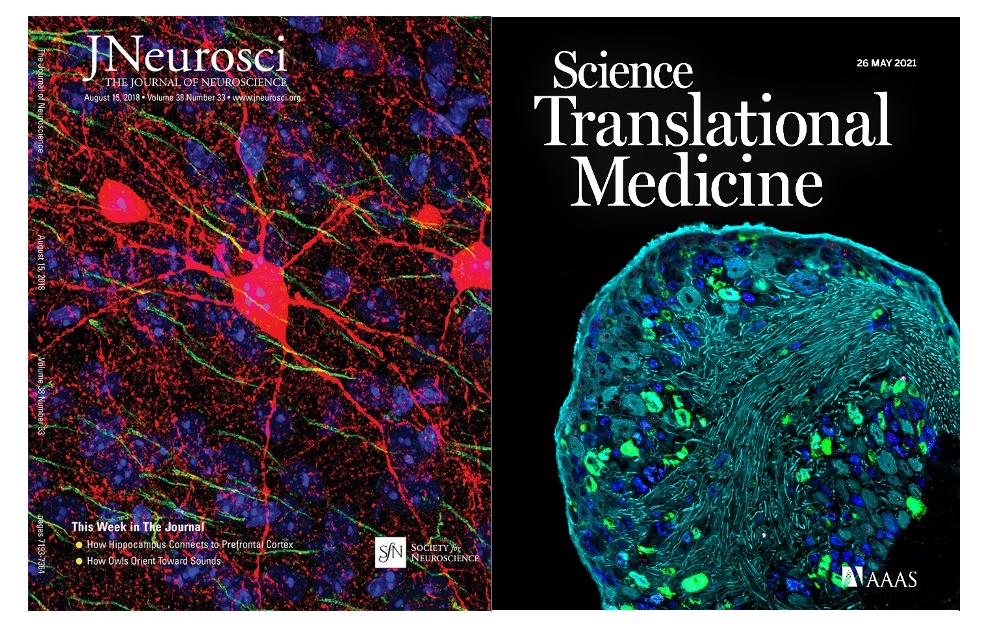
Titelbilder von Forschungszeitschriften, aufgenommen von Dr. Stephanie Shiers (The Journal of Neuroscience Band 38, Ausgabe 33 (links; nachgedruckt mit Genehmigung der Society for Neuroscience) und Science Translational Medicine Band 13, Ausgabe 595 (rechts; nachgedruckt mit Genehmigung der AAAS).
Unvergesslich bleibt mir der Moment, als ich einer Studentin half, die im Labor Schwierigkeiten beim Einfärben ihrer Proben hatte. Sie hatte noch keine Erfahrung mit der Mikroskopie, also gingen wir gemeinsam an das FV3000 Konfokalmikroskop. Ich werde ihren Gesichtsausdruck nie vergessen. Sie war vollkommen aus dem Häuschen. Das mitzuerleben war eine schöne Sache. Immerhin war es mir genauso gegangen, als ich zu Beginn meiner Doktorarbeit zum ersten Mal mit dem FV1200 System arbeitete. Es war großartig mitzuerleben, dass eine andere Person ebenfalls von den Wundern der Wissenschaft fasziniert ist. Und genau das ist es, was ich mir wünsche: dass die Menschen genau diesen Funken Magie spüren, wenn sie meine neurowissenschaftlichen Bilder zum ersten Mal sehen.
F: Was bedeutet es für Sie, dass Ihre Arbeit auf dem Titelblatt einer Fachzeitschrift erscheint?
Dr. Shiers: Ich war begeistert, weil man als Doktorand schon eine gewisse Ehrfurcht vor dem Ganzen hat. Da sind all diese Experten um einen herum, und ich hatte nicht das Gefühl, dass ich wusste, was ich tat. Es war eine stressige Zeit, aber die erfolgreichen Ergebnisse und die gelungene Präsentation der eigenen Arbeit auf dem Titelblatt einer Zeitschrift und als Artikel waren eine große Bestätigung für mich. Am Ende haben sich all die harte Arbeit und der Stress gelohnt. Das bedeutete mir damals wirklich viel. Und tut es immer noch. Die erste Abbildung auf dem Titelblatt war unglaublich – ich habe immer noch ein Video von mir, das zeigt, wie ich vor sieben Jahren einen Bilderrahmen mit meiner Titelseite hochhalte.
F: Welche Tipps und Tricks würden Sie jemandem mitgeben, der ähnliche Bilder für Titelseiten erstellen möchte?
Profi-Tipp Nr. 1: Die richtigen Instrumente verwenden.
Dr. Shiers: Während meiner Arbeit am NeuroMab habe ich viel über Hellfeld-Bildgebung und Neuroanatomie gelernt. Als ich meine Doktorarbeit begann, wandte ich dieses Wissen auf die Arbeit mit Immunfluoreszenz und komplexeren Bildgebungssystemen wie dem FV1200/FV3000 Konfokalmikroskop und dem VS200 Objektträgerscanner für die Forschung von Evident zu arbeiten. Das FV3000 System ist das beste Gerät, mit dem ich je gearbeitet habe! Im Vergleich zu den Geräten, die ich zuvor verwendet hatte, sind diese höherwertigen Mikroskopsysteme eine ganz andere Klasse, wenn es darum geht, die bestmögliche Bildqualität und das beste Signal-Rausch-Verhältnis zu erzielen.
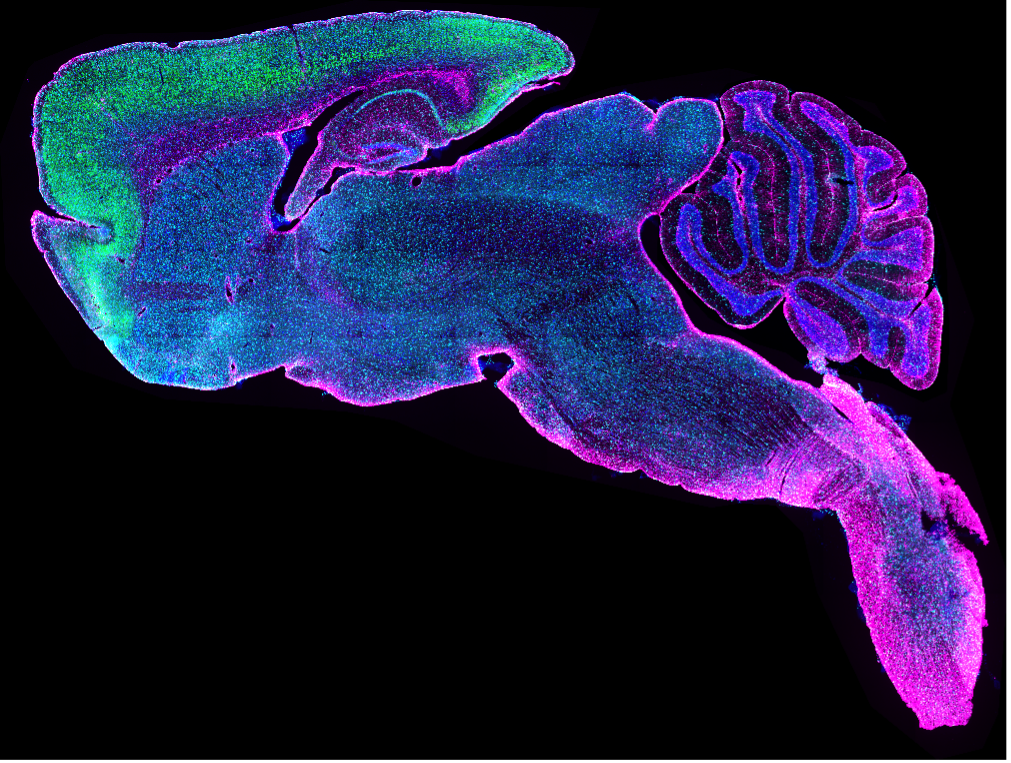
Objektträgerbild eines mit AMIGO1 (grün), IBA1 (cyan), GFAP (magenta), DAPI (blau) eingefärbten Sagittalschnitts des Mäusegehirns. Erfasst mit dem Diascanner VS120 von Dr. Stephanie Shiers.
Profi-Tipp Nr. 2: Soviel wie möglich lernen und dieses Wissen nutzen.
Dr. Shiers: Ich hatte vorher schon viel mikroskopiert, jedoch hauptsächlich mit Hellfeldbeleuchtung und Immunperoxidase-Färbung. Dafür brauchte ich kein High-Tech-Mikroskop. Ich lernte jedoch viel über Neuroanatomie, Zellspezifität, subzelluläre Lokalisierung von Proteinen und so weiter.
Bei meiner Doktorarbeit nutzte ich dann meine Vorkenntnisse, um Immunfluoreszenzfärbungen durchzuführen. Meiner Meinung nach ist das Wichtigste bei der Immunfluoreszenzfärbung die Verwendung geeigneter Negativkontrollen, weil diese sehr wichtig sind, um den Unterschied zwischen Hintergrund- und echtem Signal zu erkennen. Es ist auch sehr wichtig, dass man weiß, wie man die Mikroskope richtig benutzt. Das Expertenteam von Evident zeigte mir, wie ich komplexe Systeme wie den VS120 Objektträgerscanner und die FV1200/FV3000 Konfokalmikroskope verwenden kann.
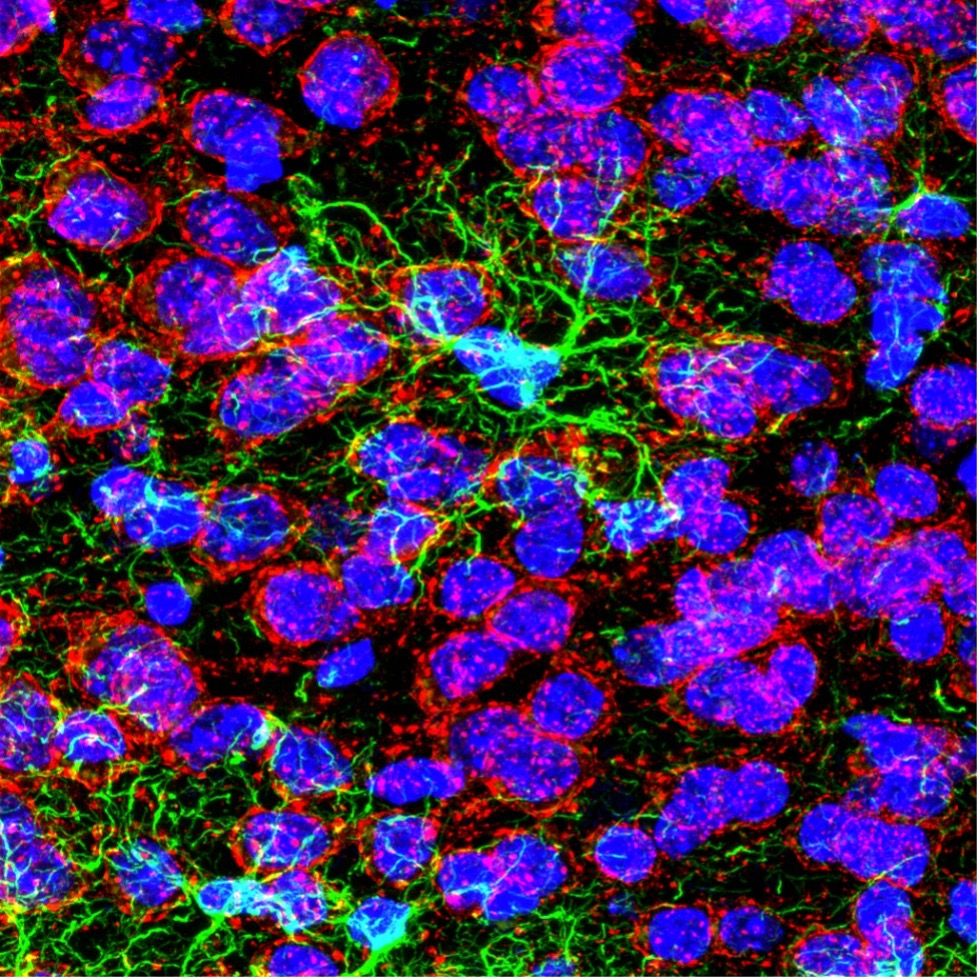
Konfokales Bild des mit GFAP (grün), DAPI (blau) und AMIGO1 (rot) eingefärbten infralimbischen Kortex einer Maus. Aufgenommen bei 100-facher Vergrößerung mit dem FV3000 Konfokalmikroskop von Dr. Stephanie Shiers.
Profi-Tipp Nr. 3: Die Bildgebung bereits bei der Datenerfassung planen.
Dr. Shiers: Ich versuche immer, meine Datenabbildungen bereits während der Erfassung des Bildmaterials zur Datenerfassung zu planen. Als Doktorandin sammelte ich Daten, analysierte sie wochenlang und stellte erst danach fest, dass ich für eine Abbildung Bilder mit höherer Auflösung brauche. Also habe ich meine Objektträger nochmal aufgenommen und gemerkt, dass sie anders aussahen als vorher. Da fragt man sich: Muss ich jetzt das ganze Experiment wiederholen? Soll ich diese Bilder trotz der geringeren Qualität in meinen Abbildungen verwenden? Wenn ich jetzt Bildmaterial zur Datenerfassung aufnehme, überlege ich immer, welche Bilder ich für die Abbildungen in meiner Forschungsarbeit verwenden werde. Wenn ich etwas finde, das repräsentativ für das ist, was ich sehe, nehme ich sofort ein Bild mit höherer Auflösung auf.
Für die Titelseite einer Zeitschrift nehme ich auch hochauflösende Bilder und gegebenenfalls Z-Stapel-Bilder auf. Ich mache immer mindestens ein Bild, das toll aussieht und eine hohe Auflösung hat.
Profi-Tipp Nr. 4: Neue Dinge ausprobieren.
Dr. Shiers: Es gibt viele verschiedene Färbemittel (Hellfeld-Pathologie-Färbemittel, Tracer, genetische Marker, Calcium-Färbemittel). Durch Verwendung dieser Färbemittel in Kombination mit leistungsstarken Mikroskopen entstehen leicht wirklich abstrakte, eindrucksvolle Bilder. In diesem Kontext erwähne ich gern meine Zusammenarbeit mit Eric Bridenbaugh von Evident, der irgendwann einmal beiläufig erwähnte, dass das FV3000 Konfokalmikroskop 6-Kanal-Immunfluoreszenz erfassen kann. Uns beiden gefiel diese Idee richtig gut, sodass wir beschlossen, es einfach auszuprobieren. Eine 6-Kanal-Bildgebung wurde aufgrund der technischen und bildgebenden Herausforderungen bis dahin eigentlich noch nie durchgeführt. Normalerweise müssen sich Wissenschaftler bei der Immunfluoreszenzfärbung aufgrund von Spezieskompatibilitätsproblemen auf 3 bis 4 Antikörper beschränken, und die Bildgebung ist aufgrund der Überschneidung der Emissionsprofile der Fluoreszenzfarbstoffe auf 3 bis 4 Kanäle begrenzt. Deshalb ist es eigentlich nicht möglich, die einzelnen Wellenlängen des Lichts herauszufiltern, um jede Färbung einzeln sichtbar zu machen. Ich wandte jedoch einen Trick an, den ich bei NeuroMab gelernt habe, und verwendete isotypspezifische Antikörper. Mit diesem Trick konnte ich eine gefärbte Probe für die 6-Kanal-Aufnahme erzeugen. Eric half mir, die TruSpectral Detektoren des FV3000 Mikroskops so zu konfigurieren, dass sie jede Färbung erfassen, und es funktionierte auf Anhieb! Wir haben diese wunderschönen, gefärbten 6-Kanal-Bilder erstellt, auf denen man jede Struktur deutlich erkennen kann. Es sieht unglaublich aus – die vielen Farben in den Bildern sind einfach brillant!
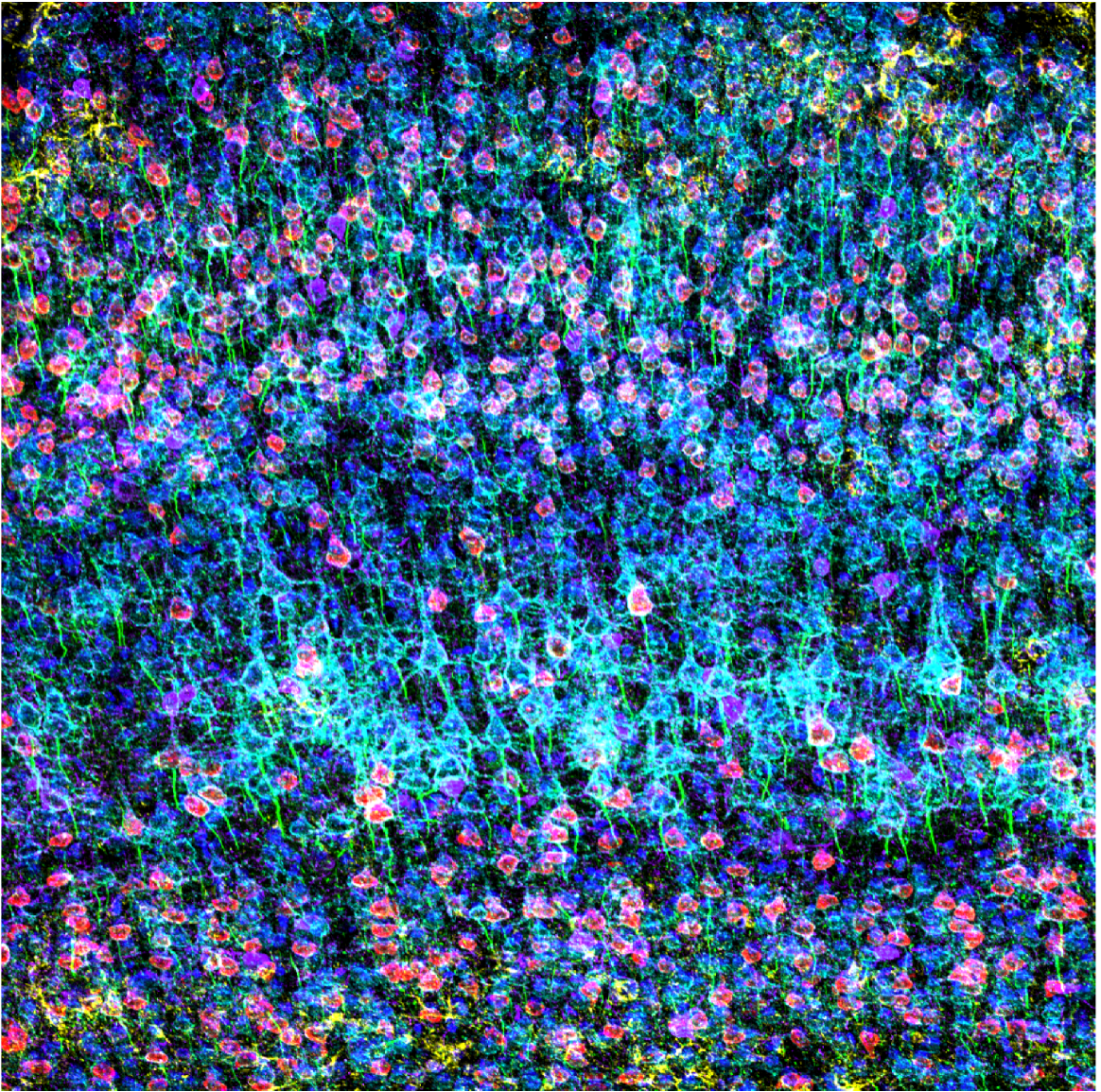
Konfokales Bild des mit GFAP (gelb), CAMKII (rot), AMIGO-1 (cyan), Parvalbumin (violett), AnkG (grün) und Nukleargelb (blau) gefärbten präfrontalen Kortex einer Maus. Aufgenommen bei 100-facher Vergrößerung mit dem FV3000 Konfokalmikroskop von Dr. Stephanie Shiers.
Profi-Tipp Nr. 5: Einfach Spaß daran haben und Bildbearbeitungswerkzeuge nutzen.
Dr. Shiers: Ich habe aus Spaß angefangen, schöne Bilder aufzunehmen, weil ich den künstlerischen Aspekt neurowissenschaftlicher Bilder liebe. Meistens habe ich natürlich schöne Bilder für die Datenerfassung gemacht, aber manchmal habe ich auch einfach nur Bilder aufgenommen, weil sie toll aussahen. So sind meine Bilder entstanden. Inzwischen habe ich einen ganzen Ordner auf dem Labor-Server mit all meinen besten Bildern. Es macht mir einfach Spaß. Bei manchen Bildern habe ich mit Photoshop experimentiert, bei anderen Farbe, Helligkeit oder Kontrast geändert. Es gibt in dem Ordner eine Menge Versionen der jeweils gleichen Bilder. Außerdem experimentiere ich gerne mit neuen Bildbearbeitungswerkzeugen und Färbemitteln. Als ich anfing, hatten wir gerade das FV3000 Konfokalmikroskop installiert und das Discovery Center an der UT Dallas eröffnet. Ich wollte dieses Mikroskop benutzen und die 100-fache Vergrößerung ausprobieren, weil wir sie bei unseren anderen Mikroskopen nicht hatten.
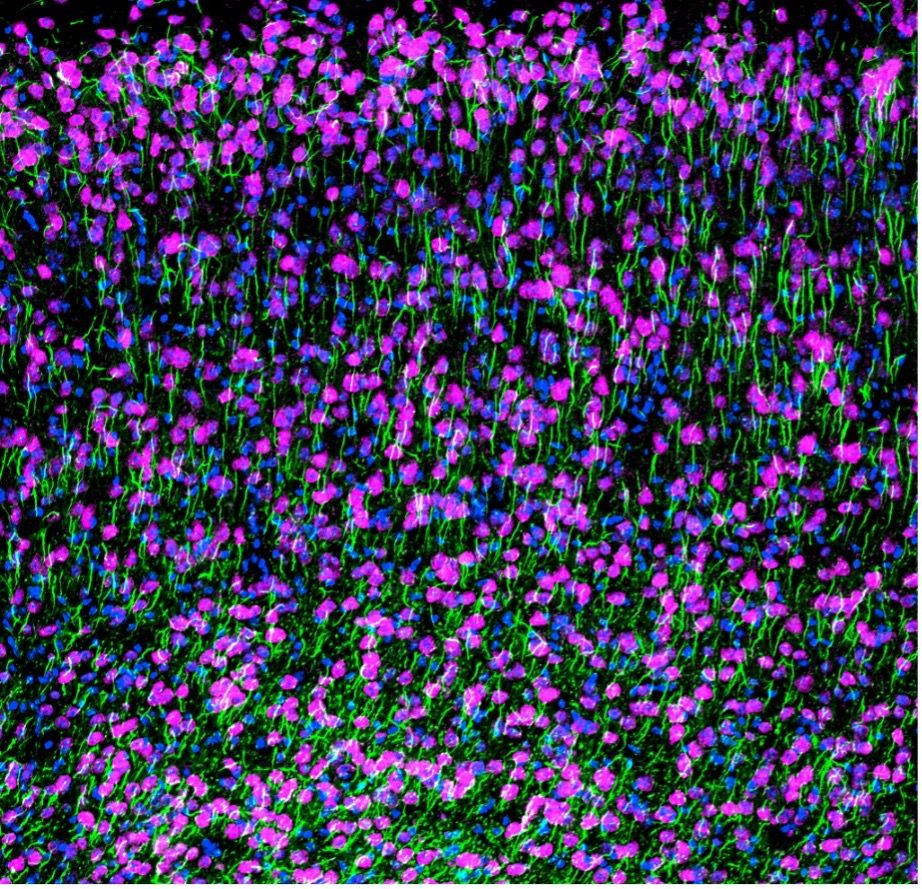
Konfokales Bild des mit NeuN (magenta), AnkG (grün) und DAPI (blau) gefärbten Kortex einer Maus. Aufgenommen mit dem FV3000 Konfokalmikroskop von Dr. Stephanie Shiers.
F: Welchen Rat würden Sie jemandem geben, der seine Mikroskopbilder gern veröffentlichen möchte?
Dr. Shiers: Reichen Sie so viele Bilder wie möglich ein. Viele Leute reichen keine Bilder für das Cover ein, weil sie denken, dass ihre Bilder dafür nicht geeignet sind. Oder sie freuen sich zu sehr darüber, dass ihr Artikel angenommen wurde, und wissen nicht, dass sie auch ein Titelbild einreichen können. Viele Zeitschriften würden aber sehr gerne Bildeinreichungen für das cover erhalten.
Außerdem ist vielen nicht klar, dass das Bild für die Titelseite einer Zeitschrift nicht genau das Bild sein muss, das sie auch für die Datenerfassung verwendet haben. Titelbilder sind oft abstrakt – fast wie eine Zeichnung. Manchmal werden sie sogar von Künstlern angefertigt.
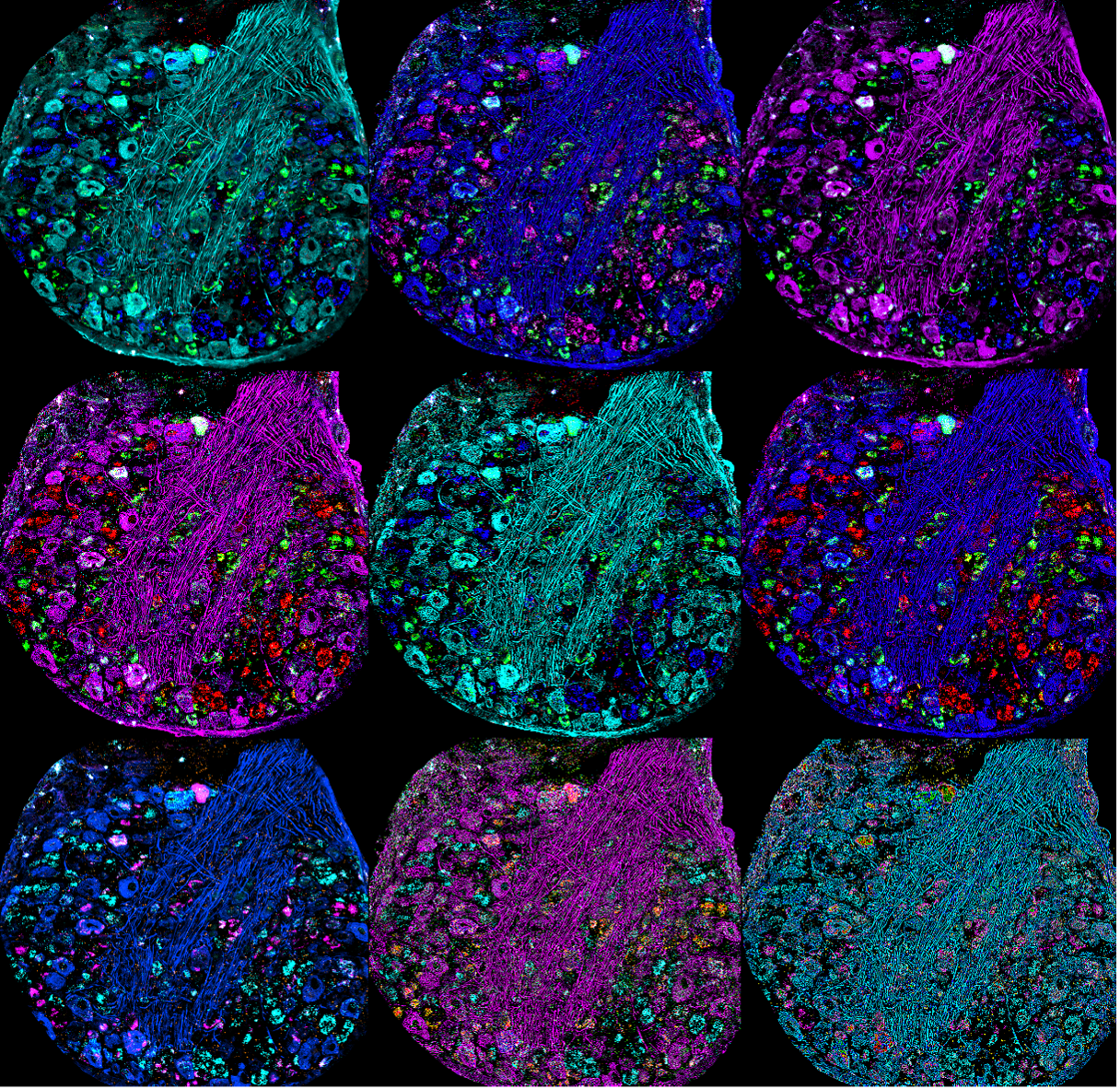
Mehrere bearbeitete Versionen einer konfokalen Darstellung eines Dorsalwurzelganglions der Maus, gefärbt mit NF200, CGRP mRNA, P2x3r mRNA und Ifnar2 mRNA. Aufgenommen mit dem FV3000 Konfokalmikroskop von Dr. Stephanie Shiers.
Ähnliche Artikel
Multiplexing mit dem Konfokalmikroskop FLUOVIEW FV3000