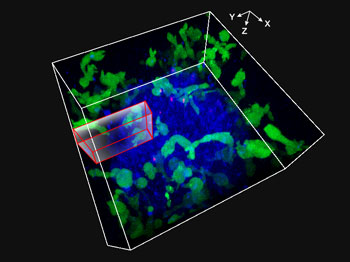
3D-Zeitrafferaufnahmen von Sphäroiden mit dem konfokalen Mikroskop FLUOVIEW FV3000: 48-stündige Dauerbeobachtung antikörperabhängiger zellvermittelter Zytotoxizität (ADCC)
Antikörperabhängige zellvermittelte Zytotoxizität (ADCC) ist einer der Wirkungsmechanismen von Antikörpermedikamenten. Effektorzellen, beispielsweise natürliche Killerzellen (NK-Zellen) und Monozyten, erkennen Zielzellen (z. B. Krebszellen), an denen ein Antikörper gebunden ist. Nach Erkennung des Antikörpers zerstören die Effektorzellen die Zielzellen, indem sie zytotoxische Faktoren freisetzen, die eine Zelllyse auslösen. In dieser Anwendung führten wir ein dreidimensionales CoKulturExperiment mit menschlichen Darmkrebszellen (HT-29) und NK-Zellen (KHYG-1), die einen funktionellen Fc-gamma (FCγ)-Rezeptor exprimieren, in Gegenwart von gegen den humanen EGFR gerichteten therapeutischen monoklonalen Antikörpern durch und beobachteten diese Zellen achtundvierzig Stunden lang mit dem konfokalen Mikroskop FLUOVIEW FV3000. Durch die daraus resultierende dreidimensionale (3D) Darstellung der ADCC konnten wir aufnehmen, wie NK-Zellen Krebszellen angreifen.
3D-Sphäroid-Bildgebung lebender Zellen mit verringerter Fototoxizität
In einem 3D-Kultursystem (einem sogenannten Sphäroid) gezüchtete Zellmassen sind aufgrund der Dicke der Masse schwer darstellbar. In der Regel ist ein Anregungslicht mit höherer Intensität erforderlich, um ein Fluoreszenzsignal zu erzeugen, das stark genug ist, um detektiert zu werden. Ein intensiveres Anregungslicht erhöht jedoch auch die Fototoxizität und schädigt die Zellen. Wir setzten deshalb das Mikroskop FV3000 mit der TruSpectral-Detektionstechnologie von Olympus ein, um selbst schwache Fluoreszenzsignale erfassen und die für die Signalerzeugung tief im Inneren eines Sphäroids erforderliche Laserstärke minimieren zu können. Darüber hinaus verwendeten wir ein 60x Silikonöl-Immersionsobjektiv (dessen Brechungsindex dem lebender Zellen sehr nahe kommt), um hellere Bilder mit höherer Auflösung für die Tiefenbetrachtung zu erzielen. Durch die Kombination dieser beiden Technologien gelang es uns, über 48 Stunden helle 3D-Zeitrafferbilder eines Sphäroids aufzunehmen, das aufgrund des durch die NK-Zellen vermittelten Tods der HT-29-Zellen kollabierte.
Related Videos |
Abb. 1: Video einer 3D-Bildgebung von NK-Zellen über 48 Stunden, die sphäroidale HT-29-Tumorzellen angreifen.
Die NK-Zelllinie KHYG-1 (grün) exprimiert funktionelle Fc-gamma(FCγ)-Rezeptoren, die ZsGreen-fluoreszierenden Proteine wurden mit Sphäroiden von HT-29-Zellen (Darmkrebs-Zelllinien) kultiviert. Die Oberflächen der HT-29-Zellen wurden mit dem monoklonalen Anti-EGFR-Antikörper Cetuximab (Alexa Fluor 647, blau) markiert. HT-29- und NK-Zellen wurden in Gegenwart von Propidiumiodid (PI) kultiviert, die XYZT-Bildgebung erfolgte über einen Zeitraum von 48 Stunden. Als Indikator für den Zelltod wurden rot markierte Kerne (spiegeln die zelluläre PI-Aufnahme wider) verwendet.
Bildgebungsbedingungen
Objektiv: 60x Silikonöl-Immersionsobjektiv (UPLSAPO60XS)
Mikroskop: FLUOVIEW FV3000
Laser: 488 nm (ZsGreen, grün), 561 nm (PI, rot), 640 nm (Alexa Fluor 647, blau)
Das Z-Drift-Kompensationssystem ermöglicht genaue Zeitrafferaufnahmen
Für Versuche zur Beurteilung der Wirksamkeit von Antikörpermedikamenten ist die Langzeit-Bildgebung lebender Zellen unverzichtbar. Um die Wirkung von NK-Zellen auf sphäroidale Krebszellen genauer zu erfassen, verwendeten wir einen Z-Drift-Kompensator (IX3-ZDC2), um Fokusveränderungen durch Außeneinflüsse (beispielsweise Temperaturschwankungen) zu verhindern. Mit dem IX3-ZDC2 konnten wir Zeitrafferbilder über einen langen Zeitraum aufnehmen, ohne den Fokus auf das Sphäroid zu verlieren. Dadurch konnten wir bestätigen, dass die NK-Zellen ihre Form aktiv verändern, wenn sie die Tumormasse angreifen und in diese eindringen.
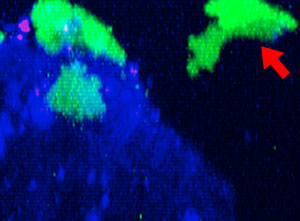 9h | 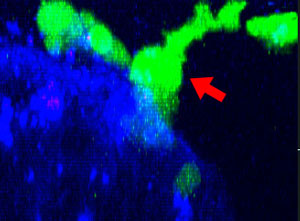 11h | 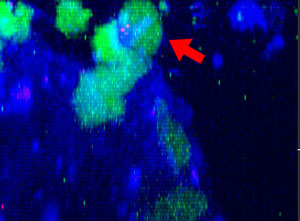 17h | 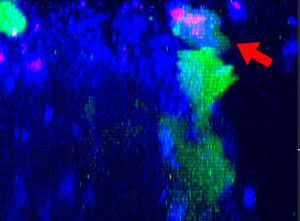 22h | 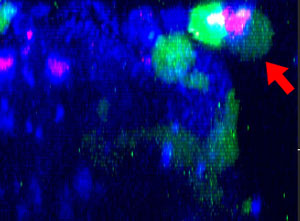 24h |
Abb. 2: Die NK-Zelllinie KHYG-1 (grün) verändert ihre Form, wenn sie mit Cetuximab (blau) markierte HT-29-Tumorzellen angreift und abtötet. Tote Zellen sind an der Aufnahme von PI (rot) erkennbar.
Vorteile des konfokalen Mikroskops FV3000 für unseren Versuch
Vollspektrum-System mit hoher Empfindlichkeit
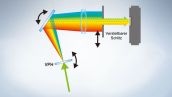
In der Serie FV3000 kommt die TruSpectral-Detektionstechnologie von Olympus zur Anwendung, bei der das Licht durch Transmission durch eine Volumen-Phasen-Hologramm-Einheit gebeugt wird. Diese Technologie erlaubt einen wesentlich höheren Lichtdurchsatz als herkömmliche spektrale Detektionseinheiten mit Reflexionsgittern und eine Minimierung der für die Betrachtung von tiefen Gewebeschichten erforderliche Laserstärke.
Den Fokus bewahren mit dem Z-Drift-Kompensationssystem (ZDC)
Der Z-Drift-Kompensator IX3-ZDC2 verwendet minimal fototoxisches Infrarotlicht (Laserklasse 1) zur Identifizierung der Probenebene. Der One-Shot-Autofokus-Modus (AF) erlaubt die Einstellung mehrerer Fokuspositionen nach Wunsch für tiefere Proben, so dass bei Versuchen mit mehreren Positionen effiziente Z-Stapel-Erfassungen möglich sind.
Related Videos |
Silikon-Immersionsobjektive für die Bildgebung von lebenden Zellen ermöglichen hochauflösende Betrachtungen in der Tiefe.
Der Brechungsindex von Silikonöl (ne≈1,40) entspricht fast dem von lebendem Gewebe (ne≈1,38) und ermöglicht hochauflösende Betrachtungen tief im lebenden Gewebe mit minimaler sphärischer Aberration aufgrund einer Brechungsindex-Fehlanpassung. Silikonöl trocknet nicht aus und verharzt nicht. Das Öl muss nicht aufgefüllt werden und eignet sich daher ideal für längere Zeitrafferaufnahmen.
Related Videos |
Kommentar von Dr. Yuji Mishima
Dr. Yuji Mishima | In den letzten Jahren hat die Nachfrage nach Fluoreszenz-Bildgebung in der Krebsforschung zugenommen, ebenso die Anzahl der Versuche, die erforderlich sind, um die Wirksamkeit von Antikörpermedikamenten - insbesondere mit sphäroidalen Zellen sterisch zu bewerten. Sphäroide sind aufgrund ihrer Dicke nur sehr schwer mit Fluoreszenz darzustellen, mit dem Mikroskop FV3000 konnten wir jedoch sphäroidale Krebszellen in ihrer Gesamtheit 48 Stunden lang beobachten. Während des gesamten ADCC-Versuchs konnten wir lebende Krebszellen, tote Zellen und Effektorzellen (NK-Zellen) in ihrer Reaktion auf die Antikörperbehandlung genau messen. Meiner Ansicht nach ist das FV3000 für die Bewertung der therapeutischen Wirksamkeit von Antikörpermedikamenten sehr effektiv. |
Danksagungen
Dieser Anwendungshinweis wurde durch Mitwirkung folgender Forscher erstellt:
The Cancer Chemotherapy Center of JFCR, Dr. Yuji Mishima
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
