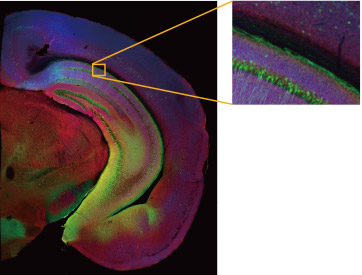
Untersuchung der neuronalen Strukturen zwischen Kortex und Thalamus im Gehirn von Krallenaffen mit dem FLUOVIEW FV3000
Der präfrontale Kortex (PFC) ist beim Menschen überproportional ausgeprägt und für komplexe kognitive und exekutive Funktionen zuständig. Bei einer Schädigung des PFC sind psychische Störungen wie Schizophrenie und Alzheimer möglich. Der PFC von Mäusen wurde intensiv erforscht, weist aber keine Region auf, die dem frontalen granulären Kortex entspricht, sodass von einem großen strukturellen Unterschied zu dem von Primaten auszugehen ist. Daher ist die Forschung an Primatenmodellen als Brücke zwischen den Untersuchungen bei der Maus und beim Menschen von großer Bedeutung. Unsere Forschungsgruppe verwendet Marmosetten – kleine, in Südamerika beheimatete Krallenaffen – als Modellprimaten.
In diesem Experiment untersuchten wir die Wechselwirkungen zwischen dem PFC und dem Nucleus reticularis im Thalamus (TRN), eine Gruppe inhibitorischer Neuronen, die den Thalamus umgeben. Der TRN wirkt quasi als Pforte zur Kontrolle der Übertragung von Informationen aus der Großhirnrinde zum Thalamus. Wir untersuchten die detaillierte Morphologie der Axonfasern im TRN, die vom PFC zum Thalamus verlaufen.
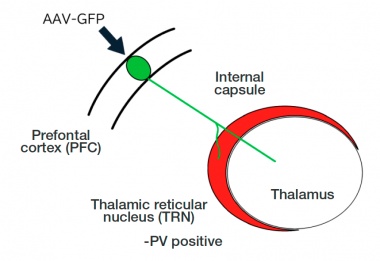
Abbildung 1: Abbildung, die zeigt, wie die neuronalen Axone vom präfrontalen Kortex durch den retikulären Thalamuskern in den Thalamus eintreten. Der Nucleus reticularis fungiert als Pforte zum Thalamus.
Makro-Mikro-Bildgebung ohne großen Aufwand
Die aus dem PFC stammenden Axonfasern durchqueren als dickes Bündel einen Korridor, der als interne Kapsel bezeichnet wird. Dieses Axonbündel tritt durch den vorderen Teil des TRN in den Thalamus ein, wo es aufgrund von Aufspaltung und Neuausrichtung komplexe Morphologien aufweist. Um den TRN genau zu identifizieren, haben wir PV (Parvalbumin) als Marker verwendet (Abb. 1).
Die Makro-Mikro-Funktion des konfokalen Laserscanning-Mikroskops FLUOVIEW FV3000 ermöglicht die fließende Verbindung von Makro- und Mikroansichten für die konfokale Bildgebung. Wir nutzten diese Funktion, um ein Übersichtsbild der Axonfasern des PFC zu erhalten, die die PV-positiven Zellen passieren, und wechselten dann zu einer starken Vergrößerung, um die Verzweigung der feinen Axonfasern und knopfartigen Nervenenden darzustellen
Für die Untersuchung bei starker Vergrößerung wurde ein Silikonöl-Immersionsobjektiv verwendet, um den tieferen Teil der Probe mit hoher Auflösung im Detail zu betrachten. Bei geringer Vergrößerung waren die dicken Axonfasern, die durch den TRN verlaufen, gerade noch erkennbar. Mit einem 40X Silikonöl-Immersionsobjektiv zeigte sich, dass die durchlaufenden Fasern fein verzweigt und mit unzähligen knopfartigen granularen Strukturen versehen waren (Abb. 2).
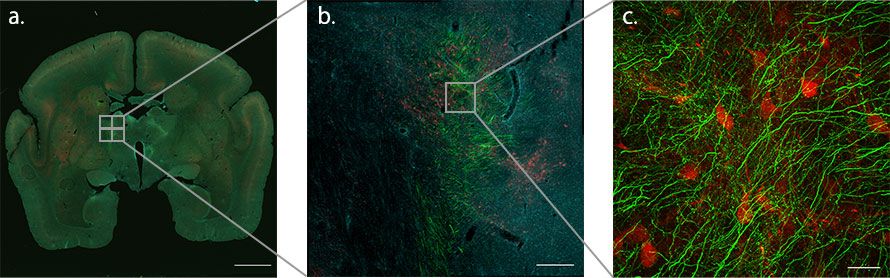
Abbildung 2: Verwendung der Makro-Mikro-Funktion, um aufzuzeigen, wo die Axonfasern auf dem Weg vom PFC zum Thalamus im Gehirn von Krallenaffen auf den TRN treffen. Da die TRN-Neuronen aus PV-positiven inhibitorischen Neuronen bestehen, können sie durch die PV-Antikörper (rot) identifiziert werden. Die Axonendigungen aus der Großhirnrinde sind grün und die Zellkerne cyan dargestellt.
Bildgebungsbedingungen
Mikroskop: Konfokales Laser-Scanning-Mikroskop FLUOVIEW FV3000
Laser: 405 nm (DAPI, cyan), 488 nm (GFP, grün), 561 nm (Parvalbumin, rot)
a. Objektiv: PLAPON1.25X, Stitching: 3 × 3, Maßstabsbalken: 3000 μm
b. Objektiv: UPLXAPO10X, Stitching: 2 × 2, Maßstabsbalken: 300 μm
c. Objektiv: UPLSAPO40XS, Stitching: 2 × 2, 73 Schichten, Maßstabsbalken: 30 μm (nur grün und rot werden angezeigt)
Hochauflösende, dreidimensionale Untersuchung der Feinstruktur von Axonfasern
Anschließend wurde ein Z-Stapel-Bild mit einem 100X Silikonöl-Immersionsobjektiv zur dreidimensionalen Rekonstruktion aufgenommen (Abb. 3). Wir konnten die detaillierten dreidimensionalen Strukturen der knopfartigen Granula, die die TRN-Neuronen umgeben, untersuchen.
Abbildung 3: 3D-Darstellung der Axonfasern im TRN auf dem Weg vom PFC zum Thalamus bei Krallenaffen bei starker Vergrößerung | Bildgebungsbedingungen |
Kommentar von Dr. Watakabe
Bei diesem Experiment mussten wir zwischen einem Objektiv mit geringer Vergrößerung und einem mit starker Vergrößerung wechseln. Die Makro-Mikro-Funktion des FV3000 Mikroskops erlaubte einen fließenden Wechsel der Vergrößerungen, sodass wir sowohl das Gehirn als Ganzes als auch dessen Feinstruktur in starker Vergrößerung untersuchen konnten. Mit dem Silikonöl-Immersionsobjektiv konnten wir die feine Morphologie der knopfartigen Nervenenden untersuchen.
Danksagung:Dr. Akiya Watakabe Laboratory for Molecular Analysis of Higher Brain Function, RIKEN Center for Brain Science |
|
Hintergrund der Forschung
Diese Forschung wurde im Rahmen des Projekts „Brain Mapping by Integrated Neurotechnologies for Disease Studies“ (Brain/MINDS) durchgeführt. Ziel dieses Projekts war es, mithilfe der Untersuchungen neuronaler Schaltkreise des Primatenmodells mehr über psychische und neurologische Erkrankungen beim Menschen und deren mögliche Behandlung zu erfahren. Dr. Watakabe gehört zu einer Forschergruppe, die die Gehirnstruktur von Krallenaffen kartiert, wobei die Verbindungen des präfrontalen Kortex (PFC) einen besonderen Schwerpunkt darstellen.
Zugehörige Arbeiten:
Okano, H., Sasaki, E., Yamamori, T., Iriki, A., Shimogori, T., Yamaguchi, Y., Kasai, K., Miyawaki, A. „Brain/MINDS.“ Neuron., 2016, Nov. 2;92(3):582-590. doi:10.1016/j.neuron.2016.10.018.
Vorteile des konfokalen Laser-Scanning-Mikroskops FV3000 für unsere Untersuchung
Makro-Mikro-Funktion erleichtert Kartierung neuronaler StrukturenMit der Makro-Mikro-Funktion des konfokalen Laser-Scanning-Mikroskops FV3000 konnten wir ohne großen Aufwand die Struktur des gesamten Gewebes erfassen und die Mikrostruktur der Zellen untersuchen. |
|
Silikonöl-Immersionsobjektive: Helle Bilder auch bei dicken Gewebeproben
Die leistungsstarken Silikonöl-Immersionsobjektive von Olympus ermöglichen die Betrachtung transparenter Proben in tiefen Gewebeschichten mit hoher Auflösung. Da der Brechungsindex von Silikonöl (NE ca.1,40) nahe am Brechungsindex von lebendem Gewebe (NE ca. 1,38) liegt, ermöglichen diese Objektive eine Vermeidung der durch unterschiedliche Brechungsindizes verursachten sphärischen Aberration und somit die 3D-Erfassung von Gewebestrukturen mit hoher Auflösung.
Related Videos |
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.