Vergleich humaner iPS-Zelllinien mithilfe des Inkubator-Überwachungssystems CM20 – Teil 3: Verringerung der Unterschiede in der Effizienz der Differenzierung zu Leberorganoiden zwischen iPS-Zelllinien
Einleitung
Organoide sind dreidimensionale Gewebe, die aus menschlichen induzierten pluripotenten Stammzellen (iPS) in vitro hergestellt werden können. Die von verschiedenen Patienten stammenden Organoide können auf funktionelle und individuelle Unterschiede hin untersucht werden. Allerdings schränkt die aufgrund der verschiedenen iPS-Linien gegebene Variabilität ihre Anwendungsmöglichkeiten ein. In dieser Forschungsarbeit wird das Inkubator-Überwachungssystem CM20 verwendet, um die morphometrischen Anhaltspunkte für die Definition der Abhängigkeit der Effizienz der Organoidbildung vom jeweiligen Spender und Klon zu ermitteln.
Analyse der mit dem CM20-Monitor erfassten Daten für die Proliferation der einzelnen humanen iPS-Zelllinien
In unserem ersten Forschungsprojekt hielten wir 12 humane iPS-Zelllinien von verschiedenen Spendern in einem undifferenzierten Zustand und überwachten sie mit dem Olympus CM20-System. Durch die langfristige, quantitative Überwachung des Zellstatus konnten wir feststellen, dass es bei bestimmten iPS-Zelllinien Unterschiede im Wachstumsprozess gab und eine Instabilität der Wachstumsgeschwindigkeit zwischen den Passagen vorlag.
In der nächsten Forschungsphase differenzierten wir dann die 12 humanen iPS-Zelllinien zu Leberorganoiden und untersuchten, ob es Unterschiede in der Organoidbildung und Differenzierungseffizienz zwischen diesen iPS-Zelllinien gab. Dabei stellten wir fest, dass die Effizienz der anschließenden Differenzierung zu Organoiden stark von Unterschieden im frühen Stadium der Proliferation während der Erhaltungskultur beeinflusst wird. Die Unterschiede in der Verdopplungszeit zwischen den iPS-Zelllinien lieferten uns jedoch keinen Hinweis darauf, ob die Qualität der gebildeten Leberorganoide gut oder schlecht ist.
Um unser Wissen zu erweitern und unsere Methoden zur Differenzierung von Leberorganoiden zu verbessern, nutzten wir Daten zum Zellwachstum während der Erhaltungskultur, die wir in der ersten Phase unserer Forschung mit dem CM20-Monitor gewonnen hatten. Wir konzentrierten uns auf zwei spezifische iPS-Zelllinien mit geringer Effizienz bei der Differenzierung zu Leberorganoiden, um ihr Verhalten im Vergleich zu anderen Zelllinien zu untersuchen. Wir fragten uns, ob es möglich ist, die Differenzierungseffizienz von differenzierungsresistenten iPS-Zellen durch eine Veränderung der Kulturbedingungen zu verbessern.
Ergebnisse
Unter den 12 bisher getesteten iPS-Zelllinien stellten wir fest, dass die Zelllinien I und J resistent gegen die Differenzierung zu Leberzellen sind. Für ein besseres Verständnis der Gründe versuchten wir anhand von Bildern, die wir mit dem CM20-Monitor in der frühen Phase der Erhaltungskultur aufgenommen hatten, Unterschiede im Verhalten der Zelllinien I und J zu finden, indem wir sie mit iPS-Zelllinien verglichen, die sich effizient zu Leberzellen differenzieren konnten.
Interessanterweise bildeten sich bei den zur Differenzierung fähigen iPS-Zelllinien (z. B. Linie L) aus den meisten Einzelzellen, die nach der Passage im frühen Stadium der Proliferation adhärent waren, Kolonien. Andererseits beobachteten wir, dass bei den Zelllinien I und J nach der Adhäsion eine höhere Zelltodrate auftrat, was zu einem deutlichen Rückgang der Koloniebildungseffizienz führte (Abb.1). Diese Tendenz wurde über mehrere Passagen hinweg reproduzierbar beobachtet. Aufgrund dieser Beobachtungen stellten wir die Hypothese auf, dass die höhere Häufigkeit des Zelltods in den frühen Stadien der Erhaltungskultur bei differenzierungsresistenten iPS-Zelllinien zu einer geringeren Anzahl von iPS-Zellkolonien führt, was letztlich die Effizienz ihrer Differenzierung zu Leberorganoiden verringert.
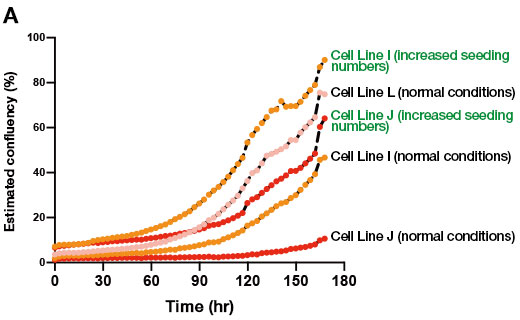
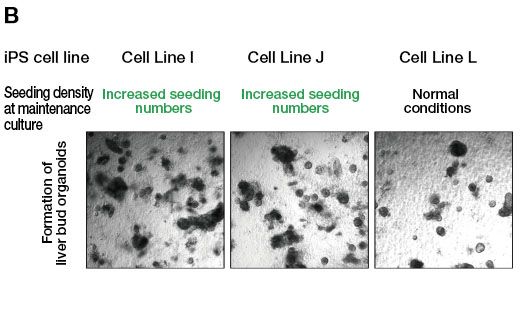
Um dies zu testen, erhöhten wir die Anzahl der ausgesäten Zellen bei der Passage, so dass die endgültige Anzahl der Kolonien derjenigen der differenzierungskompetenten iPS-Zelllinien entsprach. Anschließend versuchten wir, die Differenzierung zu Leberorganoiden in dieser Kultur zu induzieren. Wir konnten nachweisen, dass die Erhöhung der Anzahl der ausgesäten Zellen bei der Passage um das 5- bis 10-Fache im Vergleich zum Standardprotokoll zu einem Anstieg der Anzahl der gebildeten Kolonien in der differenzierungsresistenten iPS-Zell-Erhaltungskultur führte (Abb. 2A). Darüber hinaus erhielten wir bei der Erzeugung von Leberorganoiden aus den Zelllinien I und J unter diesen Bedingungen eine ausreichende Anzahl von Organoiden, wohingegen unter den vorherigen Bedingungen nur wenige Organoide gebildet wurden (Abb. 2B). Zudem stellten wir fest, dass diese Leberorganoide mehrere Lebermarker exprimierten. Diese Ergebnisse unterstreichen den Nutzen der Zellkulturüberwachungsdaten des CM20 zur Verbesserung der Anfangsphase der differenzierungsresistenten iPS-Erhaltungszellkultur und der anschließenden Differenzierung zu Leberorganoiden.
Zelllinie I | Zelllinie J | Zelllinie L |
Abb. 1. Verhalten humaner iPS-Zelllinien in den frühen Stadien der Erhaltungskultur.
|
Abb. 2: Auswirkung der Aussaatdichte auf die Organoidbildung während der Erhaltungskultur von iPS-Zellen.
(A) CM20-Überwachungsergebnisse des Wachstumsprozesses von 3 humanen iPS-Zelllinien unter normalen Bedingungen und Erhaltungskultur bei erhöhter Aussaatdichte.
(B) Bildung von Organoiden, wenn die Differenzierungsinduktion nach der Erhaltungskultur der differenzierungsresistenten Zelllinien I und J nach Erhöhung der Anzahl der ausgesäten Zellen durchgeführt wird. Zum Vergleich sind die Organoide aus der Linie L dargestellt, einer differenzierungskompetenten iPS-Zelllinie, die unter Standardbedingungen gehalten und dann zur Differenzierung angeregt wurde.
Zusammenfassung
Forscher, die mit Organoiden arbeiten, konzentrieren sich häufig auf die Optimierung der Protokolle zur Organoiddifferenzierung aus iPS-Zellen. Beim Vergleich von aus mehreren iPS-Zelllinien entstandenen Organoiden lag das Augenmerk nur selten auf der jeweiligen Erhaltungskultur. Diese Forschungsarbeit zeigte, dass der anfängliche Proliferationsstatus während der Erhaltungskultur von iPS-Zellen die spätere Effizienz der Differenzierungsinduktion erheblich beeinflusst. Dies deutet darauf hin, dass neben der Entwicklung eines Protokolls für die Organoiddifferenzierung die Optimierung des jeweiligen Protokolls für die Erhaltungskultur von iPS-Zellen entscheidend für die reproduzierbare Gewinnung von Proben mit mehreren Organoiden ist. Durch den Einsatz des Überwachungssystems CM20, das in der Lage ist, Daten der Langzeitbeobachtung von Kulturen zu speichern und quantitativ zu verarbeiten, können wir neue Erkenntnisse gewinnen und unsere Versuchsprotokolle verbessern.
Kommentare von Dr. Takebe und Dr. Yoneyama
Dr. Takanori Takebe (links) | Eine der nützlichen Funktionen des Überwachungssystems CM20 ist die Möglichkeit, das Organoid-Resultat sofort mit dem letzten Bildstapel zu verknüpfen, um den Zustand der iPS-Zellen zu bewerten. Für unser Labor war es von großem Vorteil, die Bedingungen für die Erhaltung der iPS-Zellen und die kritischen Attribute zur Verbesserung der Differenzierungseffizienz zu identifizieren. |
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.