Überprüfung der Tumormarkierung mit einer neuartigen fluoreszierenden Nanosonde mit NIR-Bildgebung
Die Fluoreszenzbildgebung (FLI) wird aufgrund ihrer Vorteile – hohe räumliche und zeitliche Auflösung, hohe Nachweisempfindlichkeit, kurze Reaktionszeit und gute Durchführbarkeit – häufig für verschiedene biomedizinische Bildgebungsverfahren im präklinischen und klinischen Bereich eingesetzt. Die Anwendung von Nahinfrarot (NIR) für die Fluoreszenzbildgebung hat spezielle Vorteile wie zum Beispiel die Möglichkeit zur Betrachtung tieferer Schichten, geringe Phototoxizität und geringe Interferenz mit der Autofluoreszenz des Gewebes. Infolgedessen hat sich die NIR-Fluoreszenzbildgebung zu einem beliebten Verfahren in der medizinischen Forschung entwickelt, insbesondere in der Tumorbehandlung.
Fluoreszenzbildgebung im NIR-II-Bereich
Anders als bei herkömmlichen fluoreszierenden Markern wie fluoreszierenden Proteinen und Farbstoffen lässt sich mit fluoreszierenden Nanosonden durch Anpassung der chemischen Zusammensetzung und morphologischen Größe leicht eine NIR-Anregungsbildgebung erreichen. Außerdem können fluoreszierende Nanosonden für die Lokalisierung, die Verabreichung von Arzneimitteln und den multimodalen Nachweis weiter modifiziert werden.
Bislang wurde eine Vielzahl von Fluoreszenzsonden untersucht, um der steigenden Nachfrage nach Möglichkeiten zur präzisen Diagnose und Behandlung von Krankheiten zu entsprechen. Die meisten herkömmlichen Fluoreszenzsonden emittieren Licht jedoch im sichtbaren oder NIR-I-Bereich (400–1000 nm). Dies schränkt ihre Einsatzmöglichkeiten in der biomedizinischen Bildgebung aufgrund von Nachteilen wie der geringen Eindringtiefe in Gewebe und der geringen räumlichen Auflösung stark ein.
Wie jüngste Studien zeigen, lässt sich die Fluoreszenzbildgebung auf den NIR-II-Bereich (1000–1700 nm) erweitern. Aufgrund der spezifischen Bildgebungseigenschaften (geringe Lichtstreuung und geringe Autofluoreszenz) besitzt dieser Bereich ein großes Potenzial für die Betrachtung tiefer Gewebeschichten, z. B. eine hohe Empfindlichkeit und Klarheit. Daher kann diese Methode in vivo wichtige Informationen liefern, die mit herkömmlicher Fluoreszenz-Bildgebung nicht ohne Weiteres erfasst werden können.
Die Technologie der Fluoreszenzbildgebung entwickelt sich zwar ständig weiter, dennoch ist es schwierig, optische Bildgebungsverfahren mit nur einer Modalität perfekt an die aktuellen Anforderungen der In-vivo-Detektion mit hoher räumlicher und zeitlicher Auflösung und hoher Empfindlichkeit in 3D anzupassen. Es besteht daher ein dringender Bedarf zur Entwicklung multimodaler optischer Erkennungssysteme.
Kombination verschiedener Biobildgebungsmethoden zur Verbesserung der Genauigkeit
Die photoakustische Bildgebung (PAI) ist eine zerstörungsfreie biomedizinische Bildgebungsmethode, die in den letzten Jahren entwickelt wurde. Wenn ein gepulster Laserstrahl in biologisches Gewebe strahlt, liefert das von den Geweben erzeugte Ultraschallsignal Informationen über die Lichtabsorptionseigenschaften des Gewebes. Folglich lassen sich bei der dualen Bildgebung durch Kombination von NIR-II FLI und NIR-I PAI die Vorteile beider Methoden nutzen, Störungen ausgleichen sowie die Bildgenauigkeit deutlich verbessern. Damit ergibt sich ein großes Anwendungspotenzial zur effizienten Diagnosestellung.
Für eine hochwertige Bildgebung ist die Konstruktion der Sonde besonders wichtig. Moleküle mit Donor-Akzeptor-Donor-Strukturen („D-A-D“) sind aufgrund ihrer ausgezeichneten Biokompatibilität, gut definierten chemischen Strukturen und anpassbaren optischen Eigenschaften für das NIR-II-Moleküldesign besonders interessant. Zur Erregung einer NIR-II-Emission wurde die stark elektronenarme Verbindung Benzo[1,2-c:4,5-c']bis([1,2,5]thiadiazol (BBTD) häufig als Akzeptor verwendet (siehe Abbildung 1a).
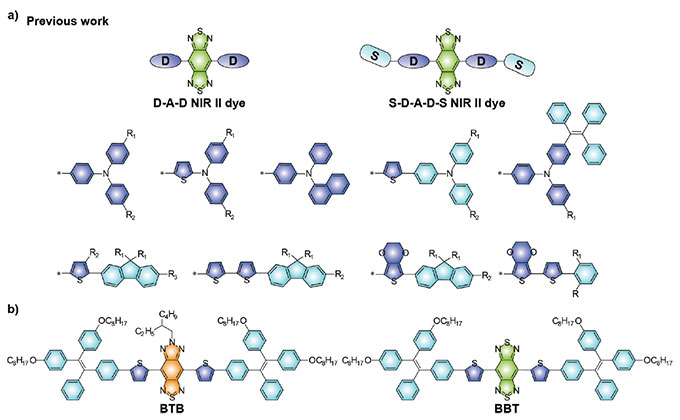
Abbildung 1. (a) Repräsentative NIR-II-Fluoreszenzmoleküle vom Typ D-A-D auf der Basis von BBTD-Rezeptoren. (b) Chemische Strukturen des NIR-II-Fluoreszenzmoleküls BTB und des fluoreszierenden Kontrollmoleküls BBT, die in der Arbeit beschrieben werden.
Die Quantenausbeuten (QYs) von fluoreszierenden NIR-II-Molekülen mit D-A-D-Struktur sind aufgrund starker intramolekularer Ladungstransfereffekte (ICT) relativ gering. Daher wurden viele Strategien zur Verbesserung der Quantenausbeuten entwickelt. Dazu gehören die Bindung von Farbstoffen an hydrophobe Proteinstrukturen, die Konstruktion von Fluorophoren mit aggregationsinduzierten Emissionseigenschaften, die Einführung von Abschirmungseinheiten in molekulare Strukturen und die Entwicklung von Anti-Burst-Molekülen.
Die Quantenausbeuten der meisten bekannten NIR-II-Fluoreszenzmoleküle mit D-A-D-Strukturen sind jedoch aufgrund der inhärenten ICT-Effekte immer noch relativ niedrig. Außerdem erfordert BBTD relativ aggressive Synthesebedingungen. Dies schränkt die Weiterentwicklung von NIR-II-Fluoreszenzmolekülen durch Funktionalisierung ein. Um mehr alternative Designstrategien für die breite Anwendung von NIR-II-Fluoreszenzmolekülen verfügbar zu machen, ist daher die Erforschung neuer Rezeptoreinheiten notwendig.
Technische Anforderungen der NIR-Fluoreszenzsonden-Bildgebung
Der In-vitro-/In-vivo-Nachweis von multimodalen NIR-Sonden stellt auch neue Herausforderungen an die bildgebenden Geräte. Anders als bei der konventionellen konfokalen Bildgebung muss die Bildgebung mit NIR-Fluoreszenzsonden folgende technischen Anforderungen erfüllen:
- Die meisten herkömmlichen konfokalen Mikroskope haben Anregungswellenlängen zwischen 400 und 650 nm. Für die NIR-Bildgebung werden NIR-Laser mit Wellenlängen von > 700 nm benötigt.
- Herkömmliche abbildende optische Komponenten (z. B. Abtastresonator, Objektiv und Gitter) erlauben eine Transmission/Kalibrierung meist nur im sichtbaren Bereich. Damit können Effizienz und Genauigkeit der NIR-Bildgebung nicht garantiert werden.
- Die NIR-Detektion erfordert einen speziellen Detektor für > 750 nm. Herkömmliche Detektoren haben im NIR-Bereich eine sehr geringe Detektionsleistung.
Neuartige fluoreszierende Nanosonde für NIR-II-Fluoreszenz und photoakustische Bildgebung
Die Gruppe von Dr. Li Kai an der SUSTech, die Gruppe von Dr. Liu Jie an der Technischen Universität Nanjing und die Gruppe von Dr. Chen Hao am Shanghai Institute of Pharmaceutical Sciences der Chinesischen Akademie der Wissenschaften schlugen gemeinsam eine molekulare Designstrategie für das Rezeptor-Engineering vor, um NIR-II-Fluoreszenzsonden mit hohen Absorptionskoeffizienten und Quantenausbeuten zu erhalten (Abbildung 1b). Diese Strategie ermöglichte funktionsspezifische Sonden für den gezielten Nachweis von Tumoren unter zwei- und dreidimensionalen Bedingungen.
Die Ergebnisse der Studie wurden am 10. November 2021 online im Journal of Materials Chemistry B in einem Artikel mit dem Titel „Receptor Engineering of Small Molecule Fluorophores for NIR-II Fluorescent and Photoacoustic Imaging“ veröffentlicht.
Wir fragten Dr. Yaxi Li, einen der Erstautoren der Arbeit, nach den wichtigsten Ergebnissen und allgemeinen Erfahrungen bei dieser Forschung:
1. Welche Vorteile bietet die neuartige fluoreszierende Nanosonde für die biologische Bildgebung?
Herkömmliche Fluoreszenzsonden zielen nicht auf den Tumor selbst ab, werden aber oft durch den EPR-Effekt (erhöhte Permeabilität und Retention) an Tumorstellen angereichert, so dass sie für die In-vivo-Bildgebung von Tumoren geeignet sind. Diese passive Anreicherung erfordert jedoch eine bestimmte Größe der Nanopartikel und ist oft ineffizient. Um die Anreicherung der fluoreszierenden Sonden an Tumorstellen zu erhöhen und den bildgebenden Effekt für eine hochpräzise Diagnose in vivo zu verbessern, wurde die Oberfläche der Nanosonde mit einem Arg-Gly-Asp (RGD) Targeting-Peptid modifiziert, um BTB-RGD NPs Nanosonden zu erhalten.
Wie in Abbildung 2a dargestellt, kam es bei der Maus, der 48 Stunden lang BTB-RGD NPs durch die große Vene injiziert wurden, zu einem signifikanten Anstieg des NIR-II-Fluoreszenzsignals an der Tumorstelle. Das Signal erreichte den Maximalwert nach 48 Stunden. Im Vergleich dazu kam es bei einer Maus der Kontrollgruppe, der BTB-NPs ohne Targeting-Fähigkeit injiziert wurden, nur zu einem schwachen Anstieg des Fluoreszenzsignals an der Tumorstelle. Die quantitative Analyse (Abbildung 2b) zeigte, dass die Signale an der Tumorstelle einer Maus, der BTB-RGD-NPs injiziert wurden, immer stärker waren als in der Kontrollgruppe.
Neben der Fluoreszenzbildgebung verwendeten wir die photoakustische Tomographie (PAT) zur Bestätigung des Targeting-Effekts der BTB-RGD-NPs insgesamt an Tumorstellen (Abbildung 2c). Die photoakustische Signalintensität an den Tumorstellen der Maus, der BTB-RGD-NPs-injiziert wurde, war ebenfalls stärker als bei der Maus der Kontrollgruppe und stimmt damit mit den Ergebnissen der NIR-II-Fluoreszenzbildgebung überein.
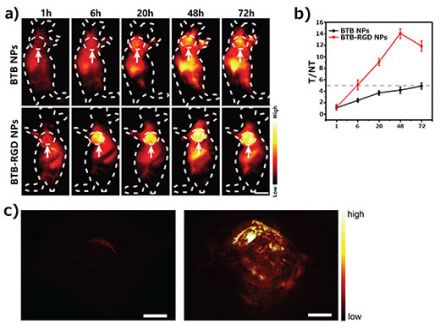
Abbildung 2. (a)Repräsentative NIR-II-Fluoreszenzbilder von Mäusen mit 143B-Tumor, aufgenommen 72 Stunden nach der Injektion von BTB-RGD NPs oder BTB-NPs mit 808-nm-Laseranregung (140 mW/cm²); Filter: 1000-nm-Langpassfilter. Die Pfeile zeigen subkutane Tumore. Anzahl der Mäuse pro Gruppe (n) = 4. Maßstableiste = 5 mm. (b) T/NT-Verhältnis des 143B-Tumors, Bildgebung über 72 Stunden Die Daten sind als Mittelwert ± SD dargestellt, n = 4. (c) Dreidimensionale photoakustische Bilder von 143B-Tumoren (Anregung mit 730 nm) bei Mäusen 48 Stunden nach Injektion von BTB (links) bzw. BTB-RGD NPs (rechts). Maßstableiste = 2 mm
Diese Ergebnisse zeigen erfolgreich das große Potenzial der von uns entwickelten Fluoreszenzsonden für die biologische Dual-Mode-Bildgebung. Zum einen wurde die hohe Empfindlichkeit der NIR-II-Fluoreszenzbildgebung erfolgreich genutzt, um eine klare zweidimensionale Bildgebung der Tumorränder zu erreichen. Zum anderen erlaubt PAT eine bessere räumliche Auflösung und 3D-Darstellung, weist aber im Vergleich zur Fluoreszenzbildgebung eine relativ geringe zeitliche Auflösung und Empfindlichkeit auf.
Dieser Dual-Imaging-Ansatz erleichtert die Rekonstruktion volumetrischer Bilder von Tumorgewebe, was für klinische Anwendungen von großem Wert ist. So können Ärzte beispielsweise die 3D-Volumeninformationen des Tumorgewebes auswerten und nach nur einer Kontrastmitteldosis eine fluoroskopische Bildgebung für die chirurgische Tumorentfernung durchführen. Die Integration dieser beiden bildgebenden Verfahren bei Gabe von lediglich einem Kontrastmittel eröffnet daher enorme Möglichkeiten für eine präzise Gefäßdarstellung und Krebsbehandlung.
2. Auf welche technischen Schwierigkeiten stießen Sie bei der Bildgebung im NIR-Bereich? Wie wurden diese gelöst?
Um die Targeting-Fähigkeit der BTB-RGD-NPs zu demonstrieren, mussten wir zunächst die Targeting-Fähigkeit für Tumorzellen durch zelluläre Assays bestimmen. Das erforderte konfokale Mikroskopie. Die meisten herkömmlichen konfokalen Mikroskope arbeiten jedoch mit Lasern für den sichtbaren Bereich. Um die NIR-II-Targeting-Sonde zu validieren, konnte die Gruppe daher die Targeting-Fähigkeit nur indirekt nachweisen, indem sie die Sonde durch eine ähnliche Konstruktion für den sichtbaren Bereich ersetzte. Ein direkter visueller Nachweis der Targeting-Fähigkeit der NIR-II-Sonde war mit diesem Ansatz nicht möglich. Außerdem erhöht sich dadurch der Arbeitsaufwand für die Vorbereitung der Sonde während des Versuchs.
Daher ist ein konfokales Mikroskop mit einem NIR-Laser besonders wichtig. Wir haben dazu ein konfokales Laserscanning-Mikroskop FLUOVIEW FV3000 verwendet, das mit der NIR-Bildgebungslösung FV3000 Red für den Nahinfrarotbereich aufgerüstet wurde. Mit dem System FV3000 Red konnte wir erfolgreich die Targeting-Fähigkeit der BTB-RGD-NPs für Tumorzellen bestimmen. In Abbildung 3 ist zu erkennen, dass nach der Inkubation mit nur 40 μg ml-1 BTB-RGD-NPs das Fluoreszenzsignal der Krebszellen signifikant stärker war als in der Kontrollgruppe mit BTB-NPs. Im Gegensatz dazu unterschied sich die Fluoreszenzintensität normaler 3T3-Zellen, die mit BTB-RGD NPs inkubiert wurden, nicht signifikant von derjenigen bei der Behandlung mit BTB NPs. Diese Ergebnisse deuten darauf hin, dass Nanopartikel nach der Funktionalisierung mit RGD ihr spezifisches Targeting für Tumorzellen, die αvβ3-Integrin überexprimieren, verstärken können.
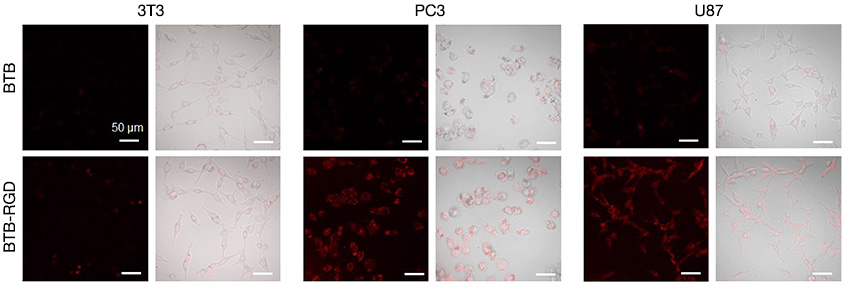
Abbildung 3: Konfokale Bilder von 3T3-, PC3- und U87-Zellen nach Inkubation mit 40 μg ml-1 BTB-RGD bzw. BTB-NPs für 4 Stunden. Anregungswellenlänge: 730 nm, Filter: 760–890 nm, Maßstableiste = 50 μm.
In früheren Experimenten konnte die Tumormarkierung nur indirekt bestätigt werden. Dazu wurde die Sonde durch eine ähnliche Konstruktion für den sichtbaren Bereich ersetzt, da der Beobachtungsbereich des Systems auf sichtbares Licht beschränkt war. Durch die Verwendung des Systems FV3000 Red in diesem Experiment konnten wir die Markierung von Tumorzellen mit BTB-RGD NPs erfolgreich messen, ohne die Sonde auszutauschen.
NIR-Lösungen für die konfokale Mikroskopie
Das System FV3000 Red erweitert die Wellenlängen-Detektionsmöglichkeiten des Mikroskops FV3000 auf den NIR-Bereich. Durch Aufrüstung der einzelnen Bildgebungsmodule für die NIR-Detektion, d. h. Laser, Optik, Objektiv und Detektor, eignet sich das System FV3000 Red als spezielle Lösung für eine empfindlichere und genauere mehrfarbige NIR-Bildgebung.
Merkmale des Systems FV3000 Red:
|
| AnmerkungenDieses Anwendungsbeispiel wurde unter Mitarbeit der folgenden Wissenschaftler verfasst: Dr. Kai Li, Southern University of Science and Technology |
Referenzen: 1.V. J. Yao, S. D'Angelo, K. S. Butler, C. Theron, T. L. Smith, S. Marchio, J. G. Gelovani, R. L. Sidman, A. S. Dobraff, C. J. Brinker, A. R. M. Bradbuty, W. Arap. und R. Pasqualini, Ligandtargeted theranostic nanomedicines against cancer, J. Control. Ausgabe 2016, 240, 267-286. 2. B. Guo, Z. Sheng, D. Hu, C. Liu, H. Zheng, B. Liu, Through Scalp and Skull NIR-II Photothermal Therapy of Deep Orthotopic Brain Tumors with Precise Photoacoustic Imaging Guidance, Adv. Mater. 2018, 30, 1802591. 3. G. L. Bagnato, N. Irrera, G. Pizzino, D. Santoro, W. N. Roberts, G. Bagnato, G. Pallio, M. Vaccaro, F. Squadrito, A. Saitta, D. Altavilla und A. Bitto, Dual αvβ3 and αvβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis, Clin. Sci. 2018, 132, 231-242. 4. N. Zoppi, N. Chiarelli, V. Cinquina, M. Ritelli, and M. Colombi, GLUT10 deficiency leads to oxidative stress and non-canonical αvβ3 integrin-mediated TGFβ signalling associated with extracellular matrix disarray in arterial tortuosity syndrome skin fibroblasts, Hum. Mol. Genet. 2015, 24, 6769-6787. 5. Y. Li, Z. Li, D. Hu, S. Wang, M. Zha, S.-B. Lu, Z. Sheng und K. Li, Targeted NIR-II emissive nanoprobes for tumor detection in mice and rabbits, Chem. Commun. 2021, 57, 6420-6423.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

