Überwachung des Einflusses von Mediumkomponenten auf das Wachstum und die Differenzierung von Leberknospenorganoiden aus humanen iPS-Zellen mit dem Olympus Provi CM20 Inkubationsüberwachungssystem
Einführung
Organoide werden in der Entwicklungsbiologie zur Erforschung der Organogenese verwendet. In der Wirkstoffforschung unterstützen sie die Aufklärung der Pathogenitätsmechanismen von Krankheiten und die Suche nach einer wirksamen Behandlung. Die Optimierung der Zellkulturbedingungen, z. B. der Wachstumsfaktoren und niedermolekularer Verbindungen, ist für die erfolgreiche Kultivierung von Organoiden unerlässlich. Derzeit werden die optimalen Zellkulturbedingungen durch Ausprobieren ermittelt. Gleichzeitig müssen die Veränderungen im Verhalten und in der Morphologie der unter den jeweiligen Bedingungen kultivierten Zellen sorgfältig beobachtet werden. In diesem Anwendungshinweis zeigen wir, dass das Olympus Provi CM20 qualitativ hochwertige Ergebnisse liefert, die für die Festlegung der optimalen Zellkulturbedingungen für Leberorganoide unerlässlich sind.
Experimenteller Abriss
Die Herstellung von Leberorganoiden aus humanen iPS-Zellen hat sich in verschiedenen Bereichen als nützlich erwiesen (Koido M et al., Nature Medicine 2020 (PMID: 32895570), Takebe T et al., Nature 2013 (PMID: 23823721)). Für dieses Experiment wurden Leberknospenorganoide in einem dreidimensionalen Kultursystem aus humanen iPS-Zellen differenziert. Untersucht wurden fünf verschiedene Bedingungen mit jeweils anderen Komponenten des Mediums, um die späteren Stadien der Leberknospendifferenzierung zu verändern (hier A, B, C, D und E). Anschließend wurden die Differenzierung und die Morphologie der Organoide analysiert, um die Wirkung der verschiedenen Verbindungen festzustellen und die optimalen Kulturbedingungen zu finden. Zur Erfassung der Informationen zu den 3D-Organoiden, die über einen Zeitraum von etwa 2 Wochen in einer 24-Well-Platte kultiviert wurden, diente ein CM20 Inkubationsüberwachungssystem (Abbildung 1).
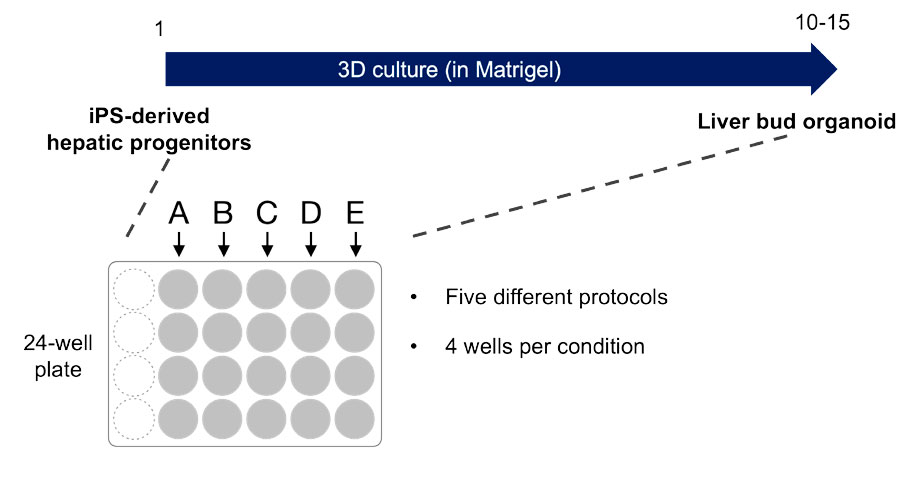
Abbildung 1: Überblick über die Versuchsbedingungen
Ergebnisse
Bei Verwendung der bereits festgelegten Bedingung A bildeten sich kugelförmige Organoide und es entwickelten sich allmählich selbstorganisierte Strukturen. Bei Verwendung der Bedingungen B und C bildeten sich morphologisch ähnliche Organoide wie bei Verwendung der Bedingungen A. Die Bedingungen D und E führten jedoch zu einer Vergrößerung des Durchmessers und zu einer größeren Anzahl der Organoide (Abbildung 2). Die mit dem CM20 System erfassten zeitlichen Daten zeigten zudem, dass die bei Verwendung der Bedingungen D und E beobachtete Lumenerweiterung etwa 4–5 Tage nach Zugabe der Verbindung auftrat (Abbildung 3).

Abbildung 2: Beobachtung humaner Leberknospenorganoide, die in einer Multiwell-Platte gezüchtet und fünf verschiedenen niedermolekularen Verbindungen ausgesetzt wurden, die ihre Differenzierung und ihr Wachstum beeinflussten
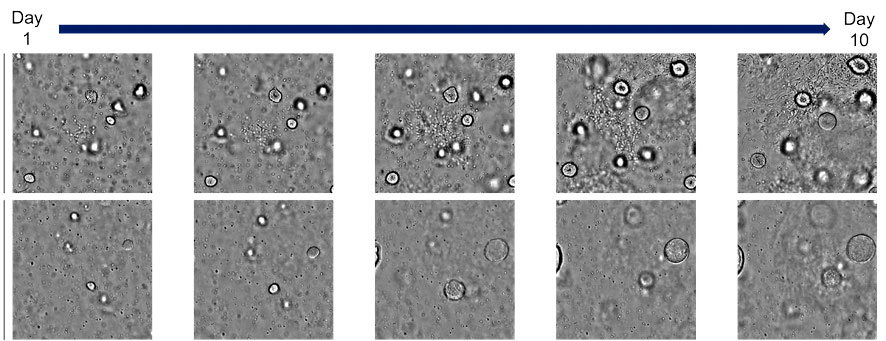
Abbildung 3: Morphologische Veränderungen in humanen Leberknospenorganoiden als Reaktion auf die Zugabe von Verbindungen
Zusammenfassung
Zusammenfassend lässt sich sagen, dass der Zustand dreidimensionaler Organoide, die in Multiwell-Platten kultiviert werden, mit dem CM20 Inkubationsüberwachungssystem im Zeitverlauf überwacht werden kann und eine vergleichende Beobachtung der verschiedenen Bedingungen möglich ist.
Kommentare von Dr. Takebe und Dr. Yoneyama


Dr. Takanori Takebe (links), Dr. Yosuke Yoneyama (rechts), Tokyo Medical and Dental University Institute of Research.
Auch wenn es wichtig ist, die Expression molekularer Marker zu analysieren, um die Effizienz der Organoiddifferenzierung zu bewerten, können die morphologischen Veränderungen in Organoiden auch nützliche Indikatoren für ihre Qualität und spätere Ergebnisse sein. Mit dem CM20 System wird der Zustand der Organoide ständig überwacht, so dass wir den Zeitpunkt, zu dem morphologische Veränderungen auftreten, nicht verpassen.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.